Billeddannelse i høj opløsning med konventionelle mikroskoper
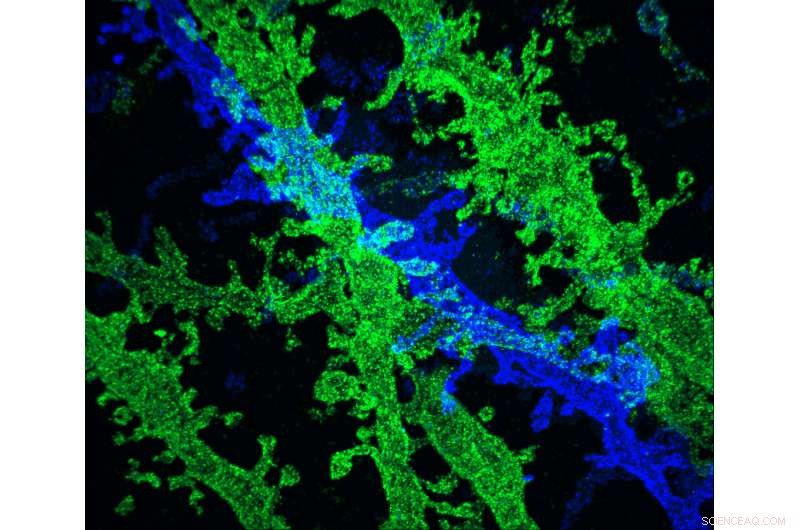
MIT forskere har udviklet en måde at lave ekstremt højopløselige billeder af vævsprøver, til en brøkdel af prisen for andre teknikker, der tilbyder lignende opløsning. Kredit:Forskerne
MIT forskere har udviklet en måde at lave ekstremt højopløselige billeder af vævsprøver, til en brøkdel af prisen for andre teknikker, der tilbyder lignende opløsning.
Den nye teknik er afhængig af at ekspandere væv før billeddannelse af det med et konventionelt lysmikroskop. To år siden, MIT-holdet viste, at det var muligt at udvide vævsvolumen 100 gange, hvilket resulterer i en billedopløsning på omkring 60 nanometer. Nu, forskerne har vist, at udvidelse af vævet en anden gang før billeddannelse kan øge opløsningen til omkring 25 nanometer.
Dette opløsningsniveau gør det muligt for videnskabsmænd at se, for eksempel, de proteiner, der klynger sammen i komplekse mønstre ved hjernesynapser, hjælper neuroner med at kommunikere med hinanden. Det kunne også hjælpe forskere med at kortlægge neurale kredsløb, siger Ed Boyden, en lektor i biologisk ingeniørvidenskab og hjerne- og kognitionsvidenskab ved MIT.
"Vi ønsker at være i stand til at spore ledningerne til komplette hjernekredsløb, siger Boyden, undersøgelsens seniorforfatter. "Hvis du kunne rekonstruere et komplet hjernekredsløb, måske kunne du lave en beregningsmodel for, hvordan det genererer komplekse fænomener som beslutninger og følelser. Da du kan kortlægge de biomolekyler, der genererer elektriske impulser i celler, og som udveksler kemikalier mellem celler, du kunne potentielt modellere hjernens dynamik."
Denne tilgang kunne også bruges til at afbilde andre fænomener såsom interaktioner mellem kræftceller og immunceller, at opdage patogener uden dyrt udstyr, og at kortlægge kroppens celletyper.
Tidligere MIT postdoc Jae-Byum Chang er den første forfatter af papiret, som vises i 17. april-udgaven af Naturens metoder .
Dobbelt udvidelse
For at udvide vævsprøver, forskerne indlejrer dem i en tæt, jævnt genereret gel lavet af polyacrylat, et meget absorberende materiale, der også bruges i bleer. Før gelen dannes, forskerne mærker de celleproteiner, de ønsker at afbilde, ved hjælp af antistoffer, der binder til specifikke mål. Disse antistoffer bærer "stregkoder" lavet af DNA, som igen er knyttet til tværbindende molekyler, der binder til de polymerer, der udgør den ekspanderbare gel. Forskerne nedbryder derefter de proteiner, der normalt holder vævet sammen, lader DNA-stregkoderne udvide sig væk fra hinanden, når gelen svulmer.
Disse forstørrede prøver kan derefter mærkes med fluorescerende prober, der binder DNA-stregkoderne, og afbildet med kommercielt tilgængelige konfokale mikroskoper, hvis opløsning normalt er begrænset til hundredvis af nanometer.
Ved at bruge den tilgang, forskerne var tidligere i stand til at opnå en opløsning på omkring 60 nanometer. Imidlertid, "individuelle biomolekyler er meget mindre end det, sige 5 nanometer eller endnu mindre, " siger Boyden. "De originale versioner af ekspansionsmikroskopi var nyttige til mange videnskabelige spørgsmål, men kunne ikke svare til ydeevnen af billeddannelsesmetoder med højeste opløsning, såsom elektronmikroskopi."
I deres oprindelige ekspansionsmikroskopi undersøgelse, forskerne fandt ud af, at de kunne udvide vævet mere end 100 gange i volumen ved at reducere antallet af tværbindende molekyler, der holder polymeren i et ordnet mønster. Imidlertid, dette gjorde vævet ustabilt.
"Hvis du reducerer tværbinderens tæthed, polymererne bevarer ikke længere deres organisation under udvidelsesprocessen, siger Boyden, som er medlem af MIT's Media Lab og McGovern Institute for Brain Research. "Du mister oplysningerne."
I stedet, i deres seneste undersøgelse, forskerne ændrede deres teknik, så efter den første vævsudvidelse, de kan skabe en ny gel, der svulmer vævet en anden gang – en tilgang, de kalder "iterativ ekspansion."
Kortlægning af kredsløb
Ved at bruge iterativ ekspansion, forskerne var i stand til at afbilde væv med en opløsning på omkring 25 nanometer, hvilket svarer til det, der opnås ved højopløsningsteknikker såsom stokastisk optisk rekonstruktionsmikroskopi (STORM). Imidlertid, ekspansionsmikroskopi er meget billigere og enklere at udføre, fordi der ikke kræves specialudstyr eller kemikalier, Boyden siger. Metoden er også meget hurtigere og dermed kompatibel med storskala, 3-D billeddannelse.
Opløsningen af ekspansionsmikroskopi svarer endnu ikke til opløsningen for scanningselektronmikroskopi (ca. 5 nanometer) eller transmissionselektronmikroskopi (ca. 1 nanometer). Imidlertid, elektronmikroskoper er meget dyre og ikke bredt tilgængelige, og med de mikroskoper, det er svært for forskere at mærke specifikke proteiner.
I den Naturens metoder papir, MIT-teamet brugte iterativ ekspansion til at billedsynapser - forbindelserne mellem neuroner, der tillader dem at kommunikere med hinanden. I deres oprindelige ekspansionsmikroskopi undersøgelse, forskerne var i stand til at afbilde stilladsproteiner, som hjælper med at organisere de hundredvis af andre proteiner, der findes i synapser. Med det nye, forbedret opløsning, forskerne var også i stand til at se strukturer i finere skala, såsom placeringen af neurotransmitterreceptorer placeret på overfladerne af de "postsynaptiske" celler på den modtagende side af synapsen.
"Mit håb er, at vi kan i de kommende år, virkelig begynde at kortlægge organisationen af disse stilladser og signalproteiner ved synapsen, " siger Boyden.
Kombination af ekspansionsmikroskopi med et nyt værktøj kaldet tidsmultipleksing skulle hjælpe med at opnå det, han tror. I øjeblikket, kun et begrænset antal farvede prober kan bruges til at afbilde forskellige molekyler i en vævsprøve. Med temporal multipleksing, forskere kan mærke et molekyle med en fluorescerende sonde, tage et billede, og vask derefter sonden væk. Dette kan så gentages mange gange, hver gang bruge de samme farver til at mærke forskellige molekyler.
"Ved at kombinere iterativ ekspansion med tidsmultipleksing, vi kunne i princippet have uendelig farve, billeddannelse i nanoskalaopløsning over store 3D-volumener, " siger Boyden. "Tingene bliver virkelig spændende nu, hvor disse forskellige teknologier snart kan forbindes med hinanden."
Forskerne håber også at opnå en tredje udvidelsesrunde, som de tror kunne, i princippet, muliggør opløsning på omkring 5 nanometer. Imidlertid, lige nu er opløsningen begrænset af størrelsen af de antistoffer, der bruges til at mærke molekyler i cellen. Disse antistoffer er omkring 10 til 20 nanometer lange, så for at få en opløsning under det, forskere ville være nødt til at skabe mindre tags eller udvide proteinerne væk fra hinanden først og derefter levere antistofferne efter ekspansion.
 Varme artikler
Varme artikler
-
 Brug af pendler i den virkelige verdenAllerede før de tidlige videnskabsmænd forstod pendulens alvor, indbragte de den til at fungere i alle slags felter. Den let genkendelige bevægelse af en vægt, der svinger jævnt frem og tilbage fra
Brug af pendler i den virkelige verdenAllerede før de tidlige videnskabsmænd forstod pendulens alvor, indbragte de den til at fungere i alle slags felter. Den let genkendelige bevægelse af en vægt, der svinger jævnt frem og tilbage fra -
 Forskere fremmer teknik til udvikling af nye lysstråler fra synkrotronstrålingKredit:CC0 Public Domain Struktureret lys, skabt ved at generere og påføre lys på en overflade, er vigtig i sådanne applikationer som 3-D scannere, dobbeltfotografering og mikroskopisk teknologi.
Forskere fremmer teknik til udvikling af nye lysstråler fra synkrotronstrålingKredit:CC0 Public Domain Struktureret lys, skabt ved at generere og påføre lys på en overflade, er vigtig i sådanne applikationer som 3-D scannere, dobbeltfotografering og mikroskopisk teknologi. -
 Nye kvidrede pulser trodser konventionel visdomEn illustration af den optiske fiber Kerr -resonator, som Rochester -forskere brugte med et spektralfilter til at skabe stærkt kvidrede laserpulser. Regnbuemønsteret i forgrunden viser, hvordan farver
Nye kvidrede pulser trodser konventionel visdomEn illustration af den optiske fiber Kerr -resonator, som Rochester -forskere brugte med et spektralfilter til at skabe stærkt kvidrede laserpulser. Regnbuemønsteret i forgrunden viser, hvordan farver -
 On-chip optisk filter behandler en lang række lysbølgelængderMIT -forskere har designet et optisk filter på en chip, der kan behandle optiske signaler fra et ekstremt bredt spektrum af lys på én gang, noget aldrig før tilgængeligt for integrerede optiksystemer,
On-chip optisk filter behandler en lang række lysbølgelængderMIT -forskere har designet et optisk filter på en chip, der kan behandle optiske signaler fra et ekstremt bredt spektrum af lys på én gang, noget aldrig før tilgængeligt for integrerede optiksystemer,
- laver videnskab, i stedet for at være videnskabsmænd, mere opmuntrende for dem, der er underrepræ…
- Forbedrede solpaneler og trykt elektronik i horisonten med ny opdagelse
- Hvad bier skaber reder i træer?
- Færre end én ud af 10 personer kan skelne online sponsoreret indhold fra nyhedsartikler
- Microsofts arbejde med kinesisk militæruniversitet rejser øjenbrynene
- Ny forskning afslører, hvad der var på menuen for middelalderbønder


