Ny mikrofluidisk enhed minimerer tab af højværdiprøver

Alexandra Ros, professor ved Arizona State University's School of Molecular Sciences og Center for Applied Structural Discovery i Biodesign Institute. Kredit:Mary Zhu
En stor samarbejdsindsats, der har udviklet sig i løbet af de sidste tre år mellem ASU og europæiske videnskabsmænd, har resulteret i et betydeligt teknisk fremskridt inden for røntgenkrystallografiske prøvestrategier.
ASU-bidraget kommer fra School of Molecular Sciences (SMS), afdeling for fysik og Biodesign Instituttet Center for Applied Structural Discovery.
Den europæiske røntgenfri elektronlaser (EuXFEL) er en forskningsfacilitet af superlativer:Den genererer ultrakorte røntgenimpulser—27, 000 gange i sekundet og med en glans, der er en milliard gange højere end den for de bedste konventionelle røntgenstrålekilder. Efter ti års byggeri, det åbnede for indledende eksperimenter i slutningen af 2017. Gruppen af Alexandra Ros, professor i ASU's SMS blev tildelt den anden tildeling af stråletid blandt verdensomspændende konkurrenter.
Deres resultater, udgivet 9. september i Naturkommunikation , validerede en unik mikrofluidisk dråbegenerator til at reducere prøvestørrelsen såvel som affald (som kan være så højt som 99 procent) i hendes teams Serial Femtosecond Crystallography (SFX) eksperimenter. Ved at bruge dette, de bestemte krystalstrukturen af enzymet 3-Deoxy-d-manno-Octulosonate 8-Phosphate Synthase (KDO8PS) og afslørede nye detaljer i en tidligere udefineret sløjferegion af enzymet, som er et potentielt mål for antibiotikaundersøgelser.
"Vi er glade for, at dette arbejde, som følge af et enormt samarbejde, er blevet godt modtaget i XFEL-fællesskabet, " forklarede Ros. "Vi videreudvikler denne metode og søger synkronisering af de mikrofluidiske dråber med pulserne fra XFEL'er. I dette øjeblik, et lille hold af ASU-studerende er netop færdig med at udføre eksperimenter ved Linac Coherent Light Source (LCLS) ved SLAC National Accelerator Laboratory i Menlo Park, CA for at forfine metoden. Der kunne ikke have været bedre timing for udgivelsen af vores arbejde."
SLAC har været den XFEL-facilitet, der er bedst kendt af amerikanske videnskabsmænd, hvor det nu berømte arbejde med krystallografi af proteinnanokrystaller (af ASU-teamet ledet af professorerne John Spence og Petra Fromme) blev udført. SLAC og dets ledsager i Europa, også i Hamborg, har haft stor succes og følgelig er blevet stærkt overbooket. Coming-on-line af det nye anlæg, med sin gigantiske 2,6-mile acceleratortunnel og atomlængdeskalaopløsning, har lettet noget af efterspørgslen på de andre faciliteter, samtidig med at de tilbyder store nye muligheder inden for de fysiske videnskaber.
SFX er en lovende teknik til proteinstrukturbestemmelse, hvor en væskestrøm indeholdende proteinkrystaller gennemskæres med en højintensitets XFEL-stråle, der er en milliard gange lysere end traditionelle synkrotron røntgenkilder.
Selvom krystallerne ødelægges af den intense XFEL-stråle umiddelbart efter, at de er blevet diffrakteret, diffraktionsinformationen kan, bemærkelsesværdigt, stadig optages takket være de avancerede detektorer. Der er udviklet kraftfulde nye dataanalysemetoder, giver et hold mulighed for at analysere disse diffraktionsmønstre og opnå elektrontæthedskort og detaljeret strukturel information om proteiner.
Metoden er specielt appellerende til svære at krystallisere proteiner, såsom membranproteiner, da det giver højopløselig strukturel information fra mikro- og endda nanokrystaller, således reducerer bidraget fra krystaldefekter og undgår den kedelige (hvis ikke umulige) vækst af de store krystaller, som kræves af traditionel synkrotronbaseret krystallografi.
Mens krystallografi med XFEL'er har været en kraftfuld teknik til at optrevle strukturerne af store proteinkomplekser og også tillade tidsopløst krystallografi, denne banebrydende videnskab skaber ikke desto mindre et stort problem. På grund af den lille "hitrate" kræver det enorme mængder suspenderet protein, som selvom det ikke er bestrålet, er besværlige at hente for de fleste proteinprøver. Hele 99 % af proteinet kan gå til spilde.
Heri ligger det store tekniske fremskridt, som Ros og hendes team har gjort. De har udviklet en 3-D-printet mikrofluidisk enhed, som er i høj opløsning, og genererer vandige-i-olie-dråber med variabel dråbesegmentering, der kan synkroniseres med de frie elektronlaserimpulser. Dette reducerer dramatisk mængden af oprenset protein, der er nødvendig for det europæiske XFEL-eksperiment, fra det i øjeblikket typiske (og næsten utilgængelige) 1 g-krav til fuld datasætregistrering.
Vigtigheden af denne udvikling bør gentages. Forskernes tilgang interleaves prøvefyldte flydende "snegle" i en offervæske, således at en hurtigt bevægende væskemikrojet opretholdes med prøve kun til stede under eksponering for femtosekund XFEL-impulser (en milliontedel af en milliardtedel af et sekund i varighed).
Holdet af videnskabsmænd har demonstreret dråbedannelse af enzymet KDO8PS krystalsuspensioner med den mikrofluidiske dråbegenerator og vist, at dråbegenereringsfrekvensen kan styres af hastighederne af de vandige og oliestrømme. Diffraktionskvaliteten af krystallerne af KDO8PS er ens, både når de injiceres i vandige dråber omgivet af olie eller ved kontinuerlig injektion med en Gas Dynamic Virtual Nozzle (GDVN), med ~60 % reduktion i prøveforbrug opnået med dråbeinjektion.
Den bestemte struktur afslørede nye detaljer i en tidligere udefineret sløjferegion af KDO8PS, et potentielt mål for antibiotikaundersøgelser. Disse resultater taler for fremtidig rutinemæssig integration af dråbegenerering ved segmenteret olieflow ved andre XFEL'er rundt om i verden.
Sidste artikelKondofysik i antiferromagnetiske Weyl -halvmetalfilm
Næste artikelMagnetiske hvirvler krystalliserer i to dimensioner
 Varme artikler
Varme artikler
-
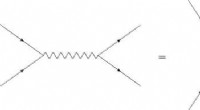 Ny forskning syntetiserer forskellige aspekter af kausalitet i kvantefeltteorienDet enkle Feynman-diagram til venstre nedbrydes i to tidsordnede diagrammer. I en af tidsbestillingerne, de sidste partikler dukker op, før de oprindelige partikler er blevet tilintetgjort. Kredit:D
Ny forskning syntetiserer forskellige aspekter af kausalitet i kvantefeltteorienDet enkle Feynman-diagram til venstre nedbrydes i to tidsordnede diagrammer. I en af tidsbestillingerne, de sidste partikler dukker op, før de oprindelige partikler er blevet tilintetgjort. Kredit:D -
 Superkrystal:En skjult fase af stof skabt af et lysudbrudEt 3D-billede af en superkrystal fra fasefeltsimuleringer ved hjælp af softwaren μ-PRO. Kredit:L-Q Chen Group, Penn State Frustration plus en puls af laserlys resulterede i en stabil superkrystal
Superkrystal:En skjult fase af stof skabt af et lysudbrudEt 3D-billede af en superkrystal fra fasefeltsimuleringer ved hjælp af softwaren μ-PRO. Kredit:L-Q Chen Group, Penn State Frustration plus en puls af laserlys resulterede i en stabil superkrystal -
 Team udvikler optisk kommunikationsteknologi for at fordoble dataoverførselshastighedenETRI-forskere diskuterer egenskaberne ved 200 Gbps QSFP-DD transceiveren. Kredit:Electronics and Telecommunications Research Institute (ETRI) Forskere i Sydkorea har udviklet en ny optisk kommunik
Team udvikler optisk kommunikationsteknologi for at fordoble dataoverførselshastighedenETRI-forskere diskuterer egenskaberne ved 200 Gbps QSFP-DD transceiveren. Kredit:Electronics and Telecommunications Research Institute (ETRI) Forskere i Sydkorea har udviklet en ny optisk kommunik -
 Forskere designer en mere holdbar MEMS -switchKredit:Binghamton University Forskere fra Binghamton University, State University of New York har udviklet en måde at gøre mobiltelefoner og elledninger mere holdbare. Binghamton University Assis
Forskere designer en mere holdbar MEMS -switchKredit:Binghamton University Forskere fra Binghamton University, State University of New York har udviklet en måde at gøre mobiltelefoner og elledninger mere holdbare. Binghamton University Assis
- Hvordan konverterer jeg M3 til kilogram?
- Fred, ikke krig, ansvarlig for skovrydning i væbnede konfliktzoner
- err http://u
- Undersøgelse analyserer, hvad der får amerikanske borgere til at støtte intervention i udlandet
- Russisk minegigant indrømmer krænkelser af affald på arktisk anlæg
- Ghosn holdt $260, 000 Rio-fest faktureret til Renault-Nissan, dokumenter viser


