Modulær blå lysfølsom fotoswitch udviklet til optogenetisk teknik
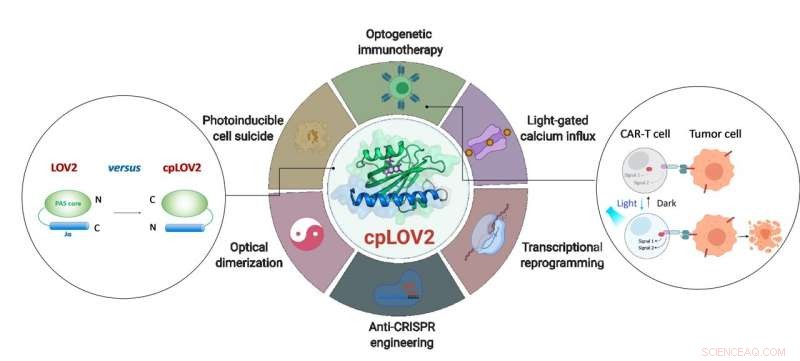
Designet af cpLOV2 og dets udvidede anvendelse i optogenetisk teknik. Kredit:ZHU Lei
For nylig, Prof. WANG Junfeng fra High Magnetic Field Laboratory ved Hefei Institutes of Physical Science (HFIPS), sammen med internationale forskere, udviklet en ny cirkulær permuteret lys-ilt-spænding 2 (LOV2) for at udvide repertoiret af genetisk kodede fotoswitches, hvilket vil fremskynde designet af nye optogenetiske enheder. Resultatet blev offentliggjort i Naturens kemiske biologi .
LOV2 domæne er en blå lysfølsom fotoswitch. I en typisk LOV2-baseret optogenetisk enhed, et effektordomæne er fusioneret efter den C-terminale Ja-helix af LOV2, har til hensigt at bur effektoren via sterisk hindring i mørke. Om fotostimulering, lysudløst udfoldning af Ja-helixen afslører effektordomænet for at genoprette dets funktion. At lave et LOV2-baseret fotoskiftbart protein kræver ofte en enorm ingeniørmæssig indsats for at optimere hver komponent og den forbindende linker derimellem. Derfor, det er ønskeligt at udvide den nuværende optogenetiske værktøjskasse ved at skabe nye moduler, der forenkler disse trin.
I dette studie, forskerne designet cpLOV2 ved hjælp af cirkulær permutation, en robust proteinteknologisk tilgang, der tidligere blev brugt til at udvikle nye varianter af genetisk kodede fluorescerende prober og biokatalysatorer. Nitrogen (N) og carbon (C) termini af cpLOV2 blev skabt ved N-terminalen af Ja helix, mens de gamle var forbundet med en glycin og serin-rig linker. Derfor, effektoren kunne fusioneres før den N-terminale Ja af cpLOV2 foruden C-terminalen i LOV2.
Ved at bruge højopløsnings-NMR-spektroskopi og andre teknikker, forskerne viste, at den strukturelle integritet og funktion af lysinduceret Ja-dissociation af cpLOV2 er velholdt. cpLOV2 var også godt bearbejdet i LOVTRAP og forbedret lysinduceret dimer (iLid), begge er LOV2-baserede optiske heterodimeriseringssystemer.
cpLOV2 gav flere valgmuligheder for optogenetiske applikationsudviklinger. Forskerne genererede en række hybrider ved at fusionere LOV2 eller cpLOV2 med forskellige Ca 2+ kanalaktiverende og autoinhiberende fragmenter afledt af stromal interaktionsmolekyle 1, og fandt flere nye cpLOV2-baserede optiske aktuatorer til gate ORAI1 Ca 2+ kanal, derfor demonstrerede de, at cpLOV2 havde råd til nye buroverflader for at overvinde begrænsninger forbundet med vildtype LOV2.
For effektorer krævede en fri N-terminal for at udføre dens fulde funktion, cpLOV2 er et bedre valg. Et nøgleprotein involveret i nekroptose, blandet lineage kinase domæne-lignende (MLKL) protein, var den vellykkede bur og uncaged i cpLOV2-MLKL, men ikke MLKL-LOV2 til optisk kontrol af celleselvmord.
Chimeric antigen receptor (CAR) T-celleterapi er dukket op som en lovende immunterapeutisk tilgang. Imidlertid, den ukontrollerbare CAR T-celleaktivitet under terapi ville forårsage alvorlige bivirkninger, f.eks. cytokinfrigivelsessyndrom hos nogle patienter. Forskere designet cpLOV2-baserede optiske heterodimeriseringssystemer (cpLID), og konstrueret foto-tunerbar split CAR (optoCAR). De terapeutiske optoCAR T-celler kan aktiveres specifikt af CD19-tumorantigen og blåt lys, og derefter spredes for at dræbe CD19 + Raji lymfomceller.
I musemodel implanteret med CD19 + Raji celler, forskere brugte upconversion nanopartikler (UCNP'er) til at omdanne det højvævsgennemtrængende nær-infrarøde lys til blåt lys og aktivere de injicerede optoCAR T-celler og opnåede yderst effektiv behandling af lymfomtumor. OptoCAR T-celler udviklet i denne undersøgelse tillader spatiotemporal og reversibel kontrol af T-celleaktiviteter og cytokinproduktion.
Disse opmuntrende resultater tyder på, at optoCAR T-celler kan afbøde potentielle bivirkninger uden at miste terapeutisk effekt. I fremtiden, de planlægger at prøve optogenetisk immunterapi til behandling af forskellige typer kræft.
 Varme artikler
Varme artikler
-
 Hvordan laver du verdens mest kraftfulde neutrinostråle?Eksperimentets design er elegant - fremstille neutrinoer og mål dem hos Fermilab, send dem direkte gennem 1, 300 kilometer jord, mål dem derefter igen i gigantiske flydende argon-detektorer på Sanford
Hvordan laver du verdens mest kraftfulde neutrinostråle?Eksperimentets design er elegant - fremstille neutrinoer og mål dem hos Fermilab, send dem direkte gennem 1, 300 kilometer jord, mål dem derefter igen i gigantiske flydende argon-detektorer på Sanford -
 Forskere identificerer vigtige tendenser i blandingslag med høj energi-densitetVisualiseringer af et simuleret blandingslag med høj energi-densitet før reshock (venstre) og efter reshock (højre). Kredit:Lawrence Livermore National Laboratory Forestil dig en flaske salatdress
Forskere identificerer vigtige tendenser i blandingslag med høj energi-densitetVisualiseringer af et simuleret blandingslag med høj energi-densitet før reshock (venstre) og efter reshock (højre). Kredit:Lawrence Livermore National Laboratory Forestil dig en flaske salatdress -
 Ny algoritme optimerer kvantecomputing-problemløsningIndlejring i en særlig graf over D-Wave 2000Q ved at løse et problem som et puslespil i vores teknik. Kredit:Tohoku University Tohoku University forskere har udviklet en algoritme, der forbedrer e
Ny algoritme optimerer kvantecomputing-problemløsningIndlejring i en særlig graf over D-Wave 2000Q ved at løse et problem som et puslespil i vores teknik. Kredit:Tohoku University Tohoku University forskere har udviklet en algoritme, der forbedrer e -
 Laserudbrud genererer elektricitet hurtigere end nogen anden metodeGruppen af Ignacio Franco, adjunkt i kemi og fysik præciserede, hvordan ultrahurtige laserpulser kan bruges til at forvrænge materiens egenskaber og generere elektriske strømme hurtigere end på noge
Laserudbrud genererer elektricitet hurtigere end nogen anden metodeGruppen af Ignacio Franco, adjunkt i kemi og fysik præciserede, hvordan ultrahurtige laserpulser kan bruges til at forvrænge materiens egenskaber og generere elektriske strømme hurtigere end på noge
- Springende og holdbare gummibelægninger kan redde tusinder af liv, siger forskere
- Forskere finder, at menneskelig indvirkning på skoven stadig er tydelig efter 500 år
- 600 tidligere EPA-embedsmænd kræver undersøgelse af Trump-administrationen over trusler i Califor…
- Nanoporøst materiale samler forurening fra vand
- NASA ser Tropical Depression Normas lille styrkeområde
- Video:Hvorfor banan slik ikke smager som banan


