Ny mikroskopimetode med superopløsning nærmer sig atomskalaen
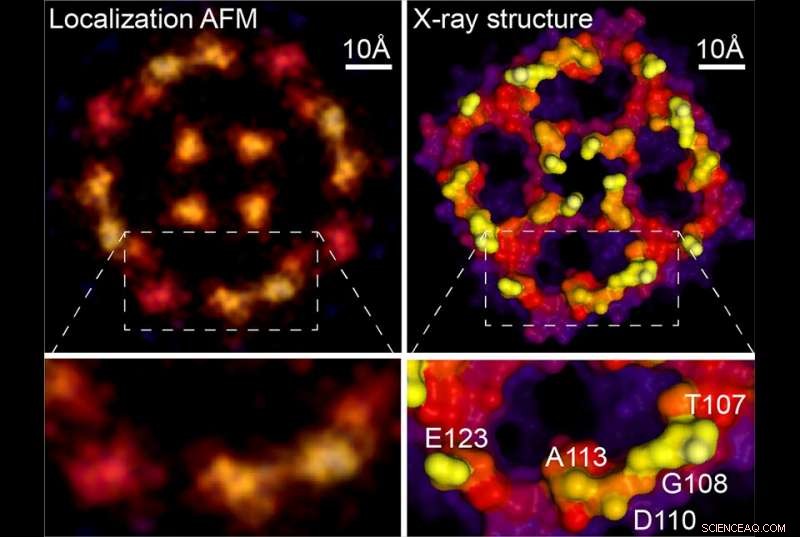
Lokalisering AFM &røntgenstruktur. Kredit:Weill Cornell Medicine, University of Leeds og Washington University
Forskere ved Weill Cornell Medicine har udviklet en beregningsteknik, der i høj grad øger opløsningen af atomkraftmikroskopi, en specialiseret type mikroskop, der "mærker" atomerne på en overflade. Metoden afslører atomniveau detaljer om proteiner og andre biologiske strukturer under normale fysiologiske forhold, åbner et nyt vindue om cellebiologi, virologi og andre mikroskopiske processer.
I en undersøgelse, udgivet 16. juni i Natur , efterforskerne beskriver den nye teknik, som er baseret på en strategi, der bruges til at forbedre opløsning i lysmikroskopi.
For at studere proteiner og andre biomolekyler i høj opløsning, efterforskere har længe stolet på to teknikker:røntgenkrystallografi og kryo-elektronmikroskopi. Mens begge metoder kan bestemme molekylære strukturer ned til opløsningen af individuelle atomer, de gør det på molekyler, der enten er stilladset i krystaller eller frosset ved ultrakolde temperaturer, muligvis ændre dem fra deres normale fysiologiske former. Atomic force microscopy (AFM) kan analysere biologiske molekyler under normale fysiologiske forhold, men de resulterende billeder har været sløret og lav opløsning.
"Atomkraftmikroskopi kan let løse atomer i fysik, på faste overflader af silikater og på halvledere, så det betyder, at maskinen i princippet har præcisionen til at gøre det, "sagde seniorforfatter Dr. Simon Scheuring, professor i fysiologi og biofysik i anæstesiologi ved Weill Cornell Medicine. "Teknikken ligner lidt, hvis du skulle tage en pen og scanne over Rocky Mountains, så du får et topografisk kort over objektet. I virkeligheden, vores pen er en nål, der er skarp ned til et par atomer, og objekterne er enkeltproteinmolekyler. "
Imidlertid, biologiske molekyler har mange små dele, der vrikker, sløre deres AFM -billeder. For at løse dette problem, Dr. Scheuring og hans kolleger tilpassede et koncept fra lysmikroskopi kaldet superopløselig mikroskopi. "Teoretisk set var det ikke muligt ved optisk mikroskopi at løse to fluorescerende molekyler, der var tættere på hinanden end halvdelen af lysets bølgelængde, sagde han. ved at stimulere de tilstødende molekyler til fluorescens på forskellige tidspunkter, mikroskopere kan analysere spredningen af hvert molekyle og lokalisere deres placeringer med høj præcision.
I stedet for at stimulere fluorescens, Dr. Scheuring's team bemærkede, at de naturlige udsving i biologiske molekyler, der blev registreret i løbet af AFM -scanninger, giver lignende spredninger af positionsdata. Første forfatter Dr. George Heath, som var postdoktor ved Weill Cornell Medicine på studietidspunktet og nu er fakultetsmedlem ved University of Leeds, engageret i cykler af eksperimenter og beregningssimuleringer for at forstå AFM -billeddannelsesprocessen mere detaljeret og udtrække den maksimale information fra atominteraktionerne mellem spids og prøve.
Ved hjælp af en metode som superopløsningsanalyse, de var i stand til at udtrække meget højere opløsning billeder af de bevægelige molekyler. Fortsætter den topografiske analogi, Dr. Scheuring forklarede, at "hvis klipperne (dvs. atomer) vrikke lidt op og ned, du kan opdage denne, så den ene, og så gennemsnit du alle detektioner over tid, og du modtager oplysninger i høj opløsning. "
Fordi tidligere AFM -undersøgelser rutinemæssigt har indsamlet de nødvendige data, den nye teknik kan anvendes retroaktivt på de slørede billeder, feltet har genereret i årtier. Som et eksempel, det nye papir indeholder en analyse af en AFM -scanning af et aquaporin -membranprotein, oprindeligt erhvervet under Dr. Scheuring's doktorafhandling. Genanalysen genererede et meget skarpere billede, der tæt matcher røntgenkrystallografistrukturer af molekylet. "Du får stort set kvasi-atomisk opløsning på disse overflader nu, "sagde Dr. Scheuring. For at fremvise metodens kraft, forfatterne leverer nye data i høj opløsning om annexin, et protein involveret i cellemembranreparation, og på en proton-chlorid-antiporter, hvoraf de også rapporterer strukturelle ændringer relateret til dets funktionelle.
Udover at tillade forskere at studere biologiske molekyler under fysiologisk relevante forhold, den nye metode har andre fordele. For eksempel, Røntgenkrystallografi og kryo-elektronmikroskopi er afhængige af gennemsnitlige data fra et stort antal molekyler, men AFM kan generere billeder af enkelte molekyler. "I stedet for at have observationer af hundredvis af molekyler, vi observerer et molekyle hundrede gange og beregner et kort i høj opløsning, "sagde Dr. Scheuring.
Billeddannelse af individuelle molekyler, når de udfører deres funktioner, kunne åbne helt nye typer analyse. "Lad os sige, at du har et [viralt] piggprotein, der er i en konformation, og derefter bliver det aktiveret og går ind i en anden konformation, "sagde Dr. Scheuring." Du ville i princippet være i stand til at beregne et kort i høj opløsning fra det samme molekyle, som det overgår fra en konformation til den næste, ikke fra tusindvis af molekyler i den ene eller den anden konformation. "Sådanne enkeltmolekylære data i høj opløsning kan give mere detaljerede oplysninger og undgå de potentielt vildledende resultater, der kan opstå, når der beregnes gennemsnit af data fra mange molekyler. Desuden kan kortet kan afsløre nye strategier for præcist at omdirigere eller afbryde sådanne processer.
 Varme artikler
Varme artikler
-
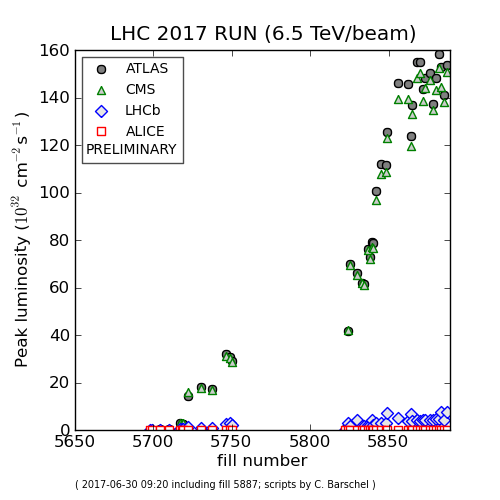 LHC samler rekorderDette plot viser værdierne for lysstyrken, som LHC har nået i løbet af de sidste par uger, med rekorden på 1,58x1034 cm -2 s -1 opnået onsdag den 28. juni. Kredit:CERN Et hidtil uset antal par
LHC samler rekorderDette plot viser værdierne for lysstyrken, som LHC har nået i løbet af de sidste par uger, med rekorden på 1,58x1034 cm -2 s -1 opnået onsdag den 28. juni. Kredit:CERN Et hidtil uset antal par -
 Nyt kvantecomputerdesign til at forudsige molekyleegenskaberKredit:Leiden Institute of Physics Standardmetoden til at bygge en kvantecomputer med majoranas som byggesten er at konvertere dem til qubits. Imidlertid, en lovende anvendelse af kvanteberegning
Nyt kvantecomputerdesign til at forudsige molekyleegenskaberKredit:Leiden Institute of Physics Standardmetoden til at bygge en kvantecomputer med majoranas som byggesten er at konvertere dem til qubits. Imidlertid, en lovende anvendelse af kvanteberegning -
 Hvad er forskellen i EPE-skum og EVA-skum?De lignende typer skum med lukket celle, ekspanderet polyethylen (EPE) og ethylen-vinylacetat (EVA) -skum udgør den største del af markedet i deres produktsektor. Begge udviser fremragende fremtrædend
Hvad er forskellen i EPE-skum og EVA-skum?De lignende typer skum med lukket celle, ekspanderet polyethylen (EPE) og ethylen-vinylacetat (EVA) -skum udgør den største del af markedet i deres produktsektor. Begge udviser fremragende fremtrædend -
 Få et kig under emhætten på topologiske isolatorerDet specifikke forhold mellem elektroniske tilstande i en topologisk isolator og momentum fører til en asymmetrisk ophobning af spin, afbildet til højre, hvilket giver anledning til elektrisk strøm ti
Få et kig under emhætten på topologiske isolatorerDet specifikke forhold mellem elektroniske tilstande i en topologisk isolator og momentum fører til en asymmetrisk ophobning af spin, afbildet til højre, hvilket giver anledning til elektrisk strøm ti
- Sikre arbejdsprotokoller kan øge sandsynligheden for, at virksomheden fejler
- NASA tilføjer kraftige regnskyl fra tyfonen Jebi
- Angriber bakterier med hajhud-inspirerede overflader
- Banana Science Projects
- Facebook løser børns app-fejl, der tillader chats med fremmede
- For et lavere klimaaftryk, vegetarisk kost slår lokalt


