Ny metode bruger lys til at muliggøre generering af ikke-kanoniske aminosyrer
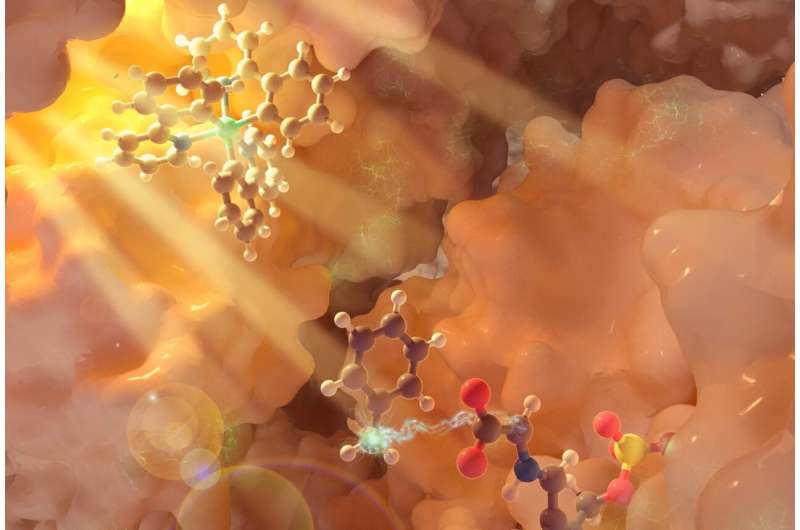
UC Santa Barbara-forskere bygger repertoiret af kemiske reaktioner ud ved hjælp af lys. I et papir offentliggjort i tidsskriftet Nature , kemiprofessor Yang Yang og samarbejdspartnere ved University of Pittsburgh rapporterer om en metode, der bruger fotobiokatalyse til at producere ikke-kanoniske (ikke naturligt forekommende) aminosyrer, der er værdifulde byggesten i peptidterapi, bioaktive naturprodukter og nye funktionelle proteiner.
"Der er gjort så mange anstrengelser inden for biokatalyse, og vi er nu på et punkt, hvor vi rationelt kan designe helt nye enzymatiske reaktioner, som er uden fortilfælde i enten kemi eller biologi," sagde Yang.
De fleste bestræbelser inden for biokatalyse eller acceleration af kemiske reaktioner via enzymer - naturens privilegerede katalysatorer - har lænet sig op mod at optimere naturlige enzymfunktioner, der er nyttige for syntetisk kemi, eller genbruge naturlige enzymer for at lette unaturlige reaktioner kendt af syntetisk kemi. På trods af et årti med omfattende forskning er der kun en håndfuld eksempler på enzymatiske reaktioner, der både er nye i naturen og nye til syntetisk kemi.
"Det, vi er interesserede i, er i bund og grund at opdage helt nye enzymatiske reaktioner og generelle måder for enzymkatalyse," tilføjede Yang.
Gå ind i fotobiokatalyse, hvor lys bruges til at excitere enzymer til at generere energi (ofte i form af frie radikaler) til at omdanne et molekyle til et andet. Fotobiokatalyse, som er et relativt ungt felt inden for kemi, udnytter selektiviteten og effektiviteten af enzymer og kombinerer det med lysets alsidighed og bæredygtighed for at skabe nye processer, og i dette tilfælde ikke-kanoniske aminosyrer.
Interagerende katalytiske processer
For denne undersøgelse fokuserede forskerholdet på pyridoxal-phosphat (PLP)-afhængige enzymer, en stor familie af enzymer, der er ansvarlige for metabolismen af aminosyrer. Holdet udviklede en interagerende, tredobbelt katalytisk cyklus, hvor en fotokatalysator - en iridiumbaseret forbindelse - udsættes for lys, hvilket sætter en proces i gang, der genererer et forbigående frit radikal, mens en anden cyklus ved hjælp af lys regenererer fotokatalysatoren.
Samtidig modificerer biokatalysecyklussen ved hjælp af et PLP-enzym aminosyresubstratet via en række aktiveringstrin, der er unikke for PLP-biokemi. Det frie radikal, der genereres fra fotokemi, kommer i spil her, kommer ind i enzymets aktive sted og engagerer det enzymatiske mellemprodukt for at muliggøre ny kemi. Dette samarbejde mellem enzymet og fotokatalysatoren tillader produktionen af et ikke-kanonisk aminosyreprodukt.
Ændringen af - i dette tilfælde - almindelige aminosyremolekylære strukturer tilføjer nye funktioner og muligheder til disse syrer. Ved at skabe en ny kulstof-kulstof-binding til det kritiske "alfa-carbon" i aminosyren, sagde Yang, bliver det muligt at bruge denne "rygrad" til at designe en række nye aminosyrer, der igen kan yde nye, unikke og ønskværdige funktioner som grundlag for nye terapier og naturlige produkter.
"Dette er den første demonstration af pyridoxisk biokatalyse via radikal-medieret alfa-funktionalisering af rigelige aminosyresubstrater," påpegede Yang.
Derudover er den meget effektive proces både stereoselektiv, hvilket betyder, at den kan vælge en foretrukken tredimensionel "form" af den resulterende aminosyre, og den eliminerer de ekstra trin med tilføjelse og fjernelse af "beskyttende grupper" eller forbindelser, der maskerer visse reaktive områder på molekyler for at forhindre uønskede kemiske reaktioner i disse områder.
"Vi har afsløret interessante interaktioner mellem fotokatalysatoren og enzymet," sagde Yang, hvis gruppe studerer, hvordan man yderligere kan forbedre interaktionerne mellem de to katalysatorer. "Jeg tror, at dette vil føre til ny grundlæggende videnskab, både fra et syntetisk kemi synspunkt og også et enzymologisk synspunkt."
 Varme artikler
Varme artikler
-
 Ny mekanisme, der flytter dråber ved rekordhøj hastighed og langdistance uden ekstra kraftKredit:CC0 Public Domain Transport af dråber på faste overflader ved høj hastighed og lange afstande uden ekstra kraft, selv mod tyngdekraften, er en formidabel opgave. Men et forskerhold beståend
Ny mekanisme, der flytter dråber ved rekordhøj hastighed og langdistance uden ekstra kraftKredit:CC0 Public Domain Transport af dråber på faste overflader ved høj hastighed og lange afstande uden ekstra kraft, selv mod tyngdekraften, er en formidabel opgave. Men et forskerhold beståend -
 Forskere opdager magnetisk overtalelse i tilstødende metallerEt diagram, der viser spiralen af ikke-kollineære magnetiske orienteringer (i pink) af et nikkelatmateriale ved siden af et manganitmateriale. Kredit:Anand Bhattacharya/Argonne National Laboratory
Forskere opdager magnetisk overtalelse i tilstødende metallerEt diagram, der viser spiralen af ikke-kollineære magnetiske orienteringer (i pink) af et nikkelatmateriale ved siden af et manganitmateriale. Kredit:Anand Bhattacharya/Argonne National Laboratory -
 Optisk chip beskytter kvanteteknologien mod fejlKredit:CC0 Public Domain I dagens digitale infrastruktur, de data-bits, vi bruger til at sende og behandle informationer, kan enten være 0 eller 1. At kunne rette mulige fejl, der kan opstå i bere
Optisk chip beskytter kvanteteknologien mod fejlKredit:CC0 Public Domain I dagens digitale infrastruktur, de data-bits, vi bruger til at sende og behandle informationer, kan enten være 0 eller 1. At kunne rette mulige fejl, der kan opstå i bere -
 Fysikere bruger kunstig intelligens til at finde de hidtil mest komplekse proteinknuderDen mest komplekse proteinknude med syv krydsninger (venstre) forudsagt af AlphaFold og en forenklet repræsentation (højre). Kredit:Maarten Brems Spørgsmålet om, hvordan den kemiske sammensætning a
Fysikere bruger kunstig intelligens til at finde de hidtil mest komplekse proteinknuderDen mest komplekse proteinknude med syv krydsninger (venstre) forudsagt af AlphaFold og en forenklet repræsentation (højre). Kredit:Maarten Brems Spørgsmålet om, hvordan den kemiske sammensætning a
- DNA fra tidlige middelalderlige alemanniske krigere og deres følge afkodet
- Dets embedsmand:De sidste fem år var de varmeste, der nogensinde er registreret
- Algetoksin produceret af brakvandsarter fundet i Oder-vand, naturlige årsager usandsynlige
- Hvordan interreligiøse ægteskaber påvirker højtider og traditioner
- DJ skal være den første sorte afrikaner i rummet, der blev dræbt i cykelulykke
- Der er ikke noget enkelt svar på, hvad der tæller som videnskab i læseundervisning


