Alkalimetaller:Grundstoffer i den første kolonne i det periodiske system

Der er alkalimetaller overalt omkring dig lige nu. Natrium findes i bordsalt, lithium i dit telefonbatteri og kalium i dine bananer.
Indhold
- Hvad er alkalimetaller?
- Hvorfor kaldes de alkalimetaller?
- Alkalimetallers kemiske egenskaber
- Hvornår blev alkalimetaller opdaget?
- Alkalimetaller i hverdagen
Hvad er alkalimetaller?
Alkalimetaller er de seks forskellige kemiske grundstoffer, der findes i den første kolonne i det periodiske system:lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cæsium (Cs) og francium (Fr).
Alkalimetallgruppen er en del af S-blokken af grundstoffer i det periodiske system, der sammen med brint, helium, calcium og andre har deres yderste elektron i en S-orbital.
Alkalimetallerne er bløde metaller, der er meget reaktive med vand og ilt. De er så bløde, at du kan skære dem med en plastikkniv. De har også en sølvlignende glans og er gode ledere af varme og lys.
Hvorfor kaldes de alkalimetaller?
Alkalimetaller kaldes så, fordi når alkalimetaller reagerer med vand, danner de stærkt alkaliske stoffer. Alkalinitet refererer til stoffets pH eller evnen til at neutralisere syre. Stoffer, der er meget alkaliske, kan danne stærke baser, der er i stand til at neutralisere syrer og opretholde et stabilt pH-niveau.
Alkalimetaller må ikke forveksles med jordalkalimetaller.
Alkalimetallers kemiske egenskaber
Hvert grundstof har en kerne, der består af protoner og neutroner, og alkalimetaller er ikke anderledes. Omkring kernen af atomer er elektroner, som er partikler med en negativ ladning. Disse elektroner findes i energiskaller omkring kernen af atomerne, som hver især kan rumme et varierende antal elektroner. Den første skal kan rumme op til to elektroner; den anden op til otte; den tredje, 18; og den fjerde, 32. Det er disse elektronskaller, og hvordan alkalimetaller er opbygget, der gør dem så reaktive.
Alle atomer ønsker naturligvis at have fuldt sæt af ydre elektroner. Imidlertid har grundstoffer i den første kolonne i det periodiske system alle en elektron i deres yderste skal. Denne ydre skal kaldes også valensskallen, og de elektroner, der opholder sig der, kaldes valenselektroner.
Høj vs. lav reaktivitet
At have kun én valenselektron i den yderste skal gør det meget nemt for alkalimetalatomerne at nå stabilitetspunkter - de skal bare miste en elektron! Denne villighed og lethed ved at miste en elektron for at nå en tilstand af ligevægt er kendt som høj reaktivitet. Faktisk er reaktivitet i kemi defineret af antallet af elektroner i den yderste skal.
Ædelgasser (grundstoffer som neon og helium) er ikke særlig reaktive, fordi deres yderste elektronskaller er fyldte. Det er derfor, kemikere taler om atomer, der ønsker at opnå en "ædelgaskonfiguration."
"Da alkalimetallerne kun har én valenselektron, opnår de typisk denne tilstand ved at opgive den elektron. I denne proces siges alkalimetallet at være oxideret, og hvad der end tager elektronen fra alkalimetallet, reduceres. Alle de alkalimetaller kan lide at opgive deres enkeltvalenselektron," siger Dr. Chip Nataro, kemiprofessor ved Lafayette College i Easton, Pennsylvania.
"Da elektroner har en ladning på -1, vil tab af en elektron få atomet til at have en ladning på +1. Når dette sker, omtales atomet som en ion, og da det ville have en positiv ladning, kaldes det en kation Så alle alkalimetaller kan godt lide at lave kationer, der har en ladning på +1."
Alkalimetaller i naturen
Da alkalimetaller reagerer let, findes de normalt sammen med andre metaller i naturen. For eksempel er natriumchlorid (bordsalt) og natriumcarbonat (soda) almindeligt tilgængelige natriumforbindelser.
Hvis et grundstof er meget reaktivt, er det sværere at finde sin rene form i naturen.
"Alle disse elementer blev først opdaget i forbindelser [og] nogle af opdagelserne er svære at tilskrive på grund af overfloden og brugen af forbindelserne," siger Nataro. "Efterhånden som du går ned i det periodiske system, bliver alkalimetallerne mere tilbøjelige til at miste deres valenselektron", og dermed "falder mængden af grundstoffet, der findes i naturen, også, [hvilket resulterer i] senere opdagelsesdatoer."
Hvornår blev alkalimetaller opdaget?
Lithium blev først opdaget i 1817, da Johan August Arfwedson, en svensk kemiker, analyserede mineralmalm. Cæsium og rubidium blev opdaget i henholdsvis 1860 og 1861 af de tyske kemikere Robert Bunsen (som lånte hans navn til Bunsen-brænderen) og Gustav Kirchhoff (som udtænkte Kirchhoffs love for elektrisk strøm). Francium, det mest reaktive af de alkalimetaller, vi i øjeblikket kender til, blev opdaget i 1939 af den franske videnskabsmand Marguerite Perey ved Curie Institute i Paris.

Natrium og kalium, to meget almindelige alkalimetaller, har ukendte opdagelsesdatoer, fordi de har været brugt så længe. Men videnskabsmænd var ikke i stand til at isolere de rene grundstoffer, før den berømte kemiker Humphrey Davy i 1807. Rubidium blev først isoleret i 1928, også af Bunsen og Kirchhoff.
Alkalimetaller reagerer kraftigt på vand og luft. Disse elementer vil danse rundt, sydende på grund af produktionen af brintgas, og ofte eksplodere. De bliver mere reaktive, jo længere nede på det periodiske system, du også kommer, hvor cæsium og francium er så reaktive, at de kan bryde i flammer blot ved at blive udsat for luften. Grundstofferne øges også i atomradius, falder i elektronegativitet og falder i smelte- og kogepunkter, når du bevæger dig ned i det periodiske system.
Du kan undre dig over, hvordan alkalimetallerne nogensinde blev opdaget i naturen, hvis de reagerer så voldsomt på luft og vand. Nå, som det viser sig, findes de fleste alkalimetaller i naturen som ioner på grund af deres høje ønske om at reagere og miste den ene valenselektron. I deres ioniske form er metallerne langt mindre reaktive.
Alkalimetaller i hverdagen
Alkalimetaller har en interessant kemisk dualitet, fordi de er meget almindelige i hverdagen, men også meget usædvanlige i deres rå grundstofform.

For eksempel er kalium- og natriumioner essentielle næringsstoffer; som elektrolytter regulerer de blodtrykket og væskebalancen i kroppen. Du kan ikke købe rene natriumatomer i butikken, men du kan finde det i mange fødevarer såvel som i bordsalt (natriumchlorid), bagepulver (natriumbicorbonat) og lud (natriumhydroxid aka kaustisk soda).
Kaliumsalte (kaliumchlorid) kan bruges til at behandle lavt kaliumindhold i blodet og er en vigtig ingrediens i handelsgødning. Kaliumhydroxid bruges i sæbeopløsninger. Kaliumnitrat (saltpeter) blev brugt til at lave krudt og er i øvrigt et fremragende fødevarekonserveringsmiddel, ansvarlig for at give hotdogs og andet forarbejdet kød deres lyserøde nuance.
Lithium bruges i batteriproduktion, og lithiumsalte bruges som et stemningsstabiliserende lægemiddel.
De mere reaktive grundstoffer, cæsium, rubidium og francium, har færre naturlige anvendelser. Cæsium bruges i atomure, boring og til at skabe optisk glas blandt andre højt specialiserede applikationer. Rubidium bruges til medicinsk billeddannelse og vakuumrør. Francium, som er meget sjældent, har ikke mange kommercielle anvendelser, men bruges i forskning og til at diagnosticere nogle former for kræft.
Endelig er alle alkalimetallerne også utrolig nyttige undervisningsredskaber inden for kemi. Lærere elsker at demonstrere princippet om reaktivitet ved at tabe et alkalimetal i vand, kun for at klassen kan se i ærefrygt, mens det spyr ild og eksploderer.
Nu er det radioaktivt!Francium er det sjældneste af alkalimetallerne og det næstsjældneste grundstof i jordskorpen (kun 340-550 gram eller omkring 1 pund anslås at være i jordskorpen). Det er også meget radioaktivt og har en maksimal levetid på kun 22 minutter. Francium er aldrig blevet tabt i vand, fordi det er så sjældent og så dyrt, men videnskabsmænd forventer, at det ville have den højeste reaktion af noget alkalimetal.
Ofte besvarede spørgsmål
Hvad er alkalimetaller?
Alkalimetallerne er en gruppe grundstoffer i det periodiske system med lignende egenskaber:De er alle skinnende, sølvhvide, meget reaktive metaller. Alkalimetallerne er lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cæsium (Cs) og francium (Fr).Sidste artikelEr Vantablack virkelig den sorteste sorte?
Næste artikelPEMDAS:Huske Maths Order of Operations
 Varme artikler
Varme artikler
-
 Forskere opnår den første acceleration af elektroner nogensinde i plasmabølgerSeongYeol Kim i ph.d. uddannelse i fysik på UNIST. Han er i øjeblikket involveret i AWAKE-samarbejdet på CERN. Kredit:Moses Chung The Large Hadron Collider (LHC) ved European Organisation for Nucl
Forskere opnår den første acceleration af elektroner nogensinde i plasmabølgerSeongYeol Kim i ph.d. uddannelse i fysik på UNIST. Han er i øjeblikket involveret i AWAKE-samarbejdet på CERN. Kredit:Moses Chung The Large Hadron Collider (LHC) ved European Organisation for Nucl -
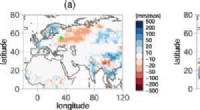 Fingeraftryk af ekstremt vejr afsløret ved ny statistisk tilgang2010 russisk hedebølge. (a) Sammensat af nedbørsanomalifelter konstrueret som i fig. 3. (b) Middel observerede anomalifelter i august 2010 (CRU TS4 datasæt). Kredit:DOI:10.1103/PhysRevLett.127.058701
Fingeraftryk af ekstremt vejr afsløret ved ny statistisk tilgang2010 russisk hedebølge. (a) Sammensat af nedbørsanomalifelter konstrueret som i fig. 3. (b) Middel observerede anomalifelter i august 2010 (CRU TS4 datasæt). Kredit:DOI:10.1103/PhysRevLett.127.058701 -
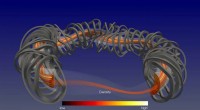 Lovende computersimuleringer til stellaratorplasmaerDet magnetiske bur genereret af de magnetiske spoler (grå) former og omslutter plasmaet. Plasmatæthedens turbulente variation skal ses i plasmatværsnittet. Kredit:IPP, A. Banon Navarro Turbulensmo
Lovende computersimuleringer til stellaratorplasmaerDet magnetiske bur genereret af de magnetiske spoler (grå) former og omslutter plasmaet. Plasmatæthedens turbulente variation skal ses i plasmatværsnittet. Kredit:IPP, A. Banon Navarro Turbulensmo -
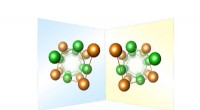 Enantiomorph distributionskort til metaller og metallegeringerÆkvivalente fragmenter af krystalstrukturerne af β-Mn enantiomorfer. De skruelignende arrangementer er dannet af manganatomer på forskellige Wyckoff-positioner (farvekodet). Kredit:MPI CPfS Venstr
Enantiomorph distributionskort til metaller og metallegeringerÆkvivalente fragmenter af krystalstrukturerne af β-Mn enantiomorfer. De skruelignende arrangementer er dannet af manganatomer på forskellige Wyckoff-positioner (farvekodet). Kredit:MPI CPfS Venstr
- Dramatisk afbrænding af kongelige rester afslører Maya-regimeskifte
- For den varmeste planet, en stor nedsmeltning, viser undersøgelse
- Undersøgelse finder en sammenhæng mellem tørke og luftkvalitet i den vestlige vildmark
- Sådan bruges formlen for ændringshastighed i matematik og fysik
- Mængden af plast dumpet i Middelhavet fordobles på 20 år:rapport
- Opdagelser af høj-Chern-nummer og høj temperatur Chern-isolatorstater


