Neutronspredning forklarer, hvordan myoglobin kan fungere uden vand
Her er hvordan neutronspredning har bidraget til vores forståelse af myoglobins adfærd uden vand:
Proteindynamik:Neutronspredningsforsøg, der involverer deutereret myoglobin, har gjort det muligt for forskere at studere proteinets dynamik i detaljer. Ved selektivt at erstatte brintatomer med deuterium (en tungere isotop af brint), kan specifikke vibrationstilstande og bevægelser i proteinet observeres. Disse undersøgelser har vist, at myoglobin undergår subtile konformationelle ændringer ved dehydrering, men disse ændringer ændrer ikke væsentligt dets overordnede struktur eller funktion.
Hydration Shell:Neutronspredningsforsøg har også givet information om hydreringsskallen omkring myoglobin. I fravær af bulkvand kan myoglobinmolekyler stadig bevare et tæt bundet lag af vandmolekyler, der direkte interagerer med proteinets overflade. Denne hydreringsskal spiller en afgørende rolle i at opretholde proteinets stabilitet og konformationelle dynamik, selv under tørre forhold.
Ligandbinding:Neutronspredningsforsøg har undersøgt, hvordan myoglobin binder til ilt i fravær af vand. Ved at bruge neutronkilder, der giver højenergi-neutronstråler, kan forskere selektivt undersøge de vibrationstilstande, der er forbundet med oxygen-jernbindingen i myoglobinmolekylet. Disse undersøgelser har vist, at myoglobin kan binde til ilt uden tilstedeværelsen af vandmolekyler, hvilket tyder på en iboende evne af proteinet til at lette iltbinding og frigivelse.
Proteinfleksibilitet:Neutronspredningsforsøg har også afsløret fleksibiliteten af myoglobin i fravær af vand. Ved at analysere proteinets lavenergi-vibrationstilstande har forskere observeret, at myoglobin bevarer sin evne til at gennemgå subtile strukturelle udsving selv i et tørt miljø. Denne fleksibilitet er afgørende for proteinets funktion, da den muliggør konformationsændringer, der er nødvendige for iltbinding og frigivelse.
Implikationer for cellulære processer:Resultaterne fra neutronspredningsforsøg har implikationer for forståelsen af cellulære processer under forhold med dehydrering eller begrænset vandtilgængelighed. Myoglobins evne til at fungere uden vand tyder på, at visse proteiner kan bevare deres strukturelle integritet og funktionalitet under ekstreme forhold, som kan være relevante i forskellige fysiologiske sammenhænge, såsom cellulære stressresponser eller tilpasning til tørre miljøer.
Sammenfattende har neutronspredningsforsøg givet værdifuld indsigt i, hvordan myoglobin kan udføre sine funktioner uden vand. Ved at afsløre proteinets strukturelle stabilitet, dynamik og ligandbindingsevne under tørre forhold, har neutronspredning udvidet vores forståelse af proteinadfærd og dets implikationer for cellulære processer i forskellige miljøer.
 Varme artikler
Varme artikler
-
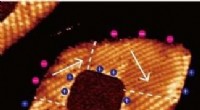 Fysikere skaber polarisationsvirvler i et todimensionelt materialeScanning af tunnelografisk mikroskop topografisk billede af en SnTe/PbTe monolags lateral heterostruktur. Den paraelektriske PbTe -monolagskerne (mørk) er omgivet af et ferroelektrisk SnTe -enkeltlag,
Fysikere skaber polarisationsvirvler i et todimensionelt materialeScanning af tunnelografisk mikroskop topografisk billede af en SnTe/PbTe monolags lateral heterostruktur. Den paraelektriske PbTe -monolagskerne (mørk) er omgivet af et ferroelektrisk SnTe -enkeltlag, -
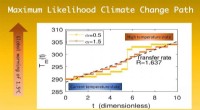 Kortlægning af klimaændringernes vejDen maksimale sandsynlighedsovergang fra den aktuelle temperaturtilstand til den varmere for global opvarmning, under påvirkning af Levy -støj og drivhuseffekten. (y-aksen er temperaturen i Kelvin; x-
Kortlægning af klimaændringernes vejDen maksimale sandsynlighedsovergang fra den aktuelle temperaturtilstand til den varmere for global opvarmning, under påvirkning af Levy -støj og drivhuseffekten. (y-aksen er temperaturen i Kelvin; x- -
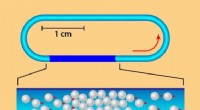 Forskere observerer faseovergang i kunstigt skabt flok(Top) Skitse af opsætningen brugt af Bartolo og kolleger [1]. Millioner af mikroperler, som ruller ved påføring af et elektrisk felt, udforske en centimeter-størrelse racerbane-formet indhegning. (Bun
Forskere observerer faseovergang i kunstigt skabt flok(Top) Skitse af opsætningen brugt af Bartolo og kolleger [1]. Millioner af mikroperler, som ruller ved påføring af et elektrisk felt, udforske en centimeter-størrelse racerbane-formet indhegning. (Bun -
 Bioinspireret metagel med afstembar bredbåndsimpedansEt design af BMIT baseret på delfinens struktur. (A) Tredimensionel akustisk impedansfordeling af delfinens hoved og en sektioneret vævsprøve (fotokredit:Zhongchang Song). (B) Akustisk impedansprofil
Bioinspireret metagel med afstembar bredbåndsimpedansEt design af BMIT baseret på delfinens struktur. (A) Tredimensionel akustisk impedansfordeling af delfinens hoved og en sektioneret vævsprøve (fotokredit:Zhongchang Song). (B) Akustisk impedansprofil
- Hvilke funktioner har Nephridia i regnorme?
- At teste læsefærdigheder i dag kræver mere end en blyant og papir
- Forskere øger lægemidlets effektivitet ved at bruge nanopartikler til at målrette cellernes kraft…
- Forskere analyserer brugen af sociale medier til at påvirke politik under opstanden
- Ny indsigt i at bevise matematisk millionproblem:Riemann-hypotesen (opdatering)
- Den ubarmhjertige stigning i migration i Europa i løbet af de sidste 10, 000 år


