Er trykket fra gas et resultat af idealloven?
Det tryk, som en gas udøver, skyldes, at gaspartiklerne kolliderer med beholderens vægge. Idealgasloven beskriver gassers adfærd under ideelle forhold, hvilket betyder, at gaspartiklerne antages at være punktpartikler uden vekselvirkninger mellem dem.
I virkeligheden interagerer gaspartikler med hinanden, og disse interaktioner kan påvirke det tryk, som gassen udøver. For eksempel ved høje tryk er der større sandsynlighed for, at gaspartiklerne kolliderer med hinanden, hvilket kan få trykket til at stige.
Den ideelle gaslov er en god tilnærmelse til opførsel af gasser ved lave tryk og høje temperaturer, men den beskriver ikke nøjagtigt opførsel af gasser ved høje tryk eller lave temperaturer.
 Varme artikler
Varme artikler
-
 Et strejf af guld forbedrer mikrolasereKredit:CC0 Public Domain Guld. Ordet tænker på vielsesringe, begravet skat og Californien i 1840erne. Men når guld reduceres til 1/100, 000 på størrelse med et menneskehår, det får en helt ny pers
Et strejf af guld forbedrer mikrolasereKredit:CC0 Public Domain Guld. Ordet tænker på vielsesringe, begravet skat og Californien i 1840erne. Men når guld reduceres til 1/100, 000 på størrelse med et menneskehår, det får en helt ny pers -
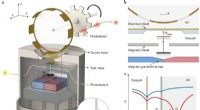 Udvidede tests med svævende kraftsensor kan ikke finde bevis for femte kraftSkematisk af eksperimentet. a, Kamæleonfeltets femte kraft genereres af otte tynde film (kildemasser) af polyimid med en tykkelse på 75 μm, fordelt ligeligt på en roterende plade. Kraftsensoren består
Udvidede tests med svævende kraftsensor kan ikke finde bevis for femte kraftSkematisk af eksperimentet. a, Kamæleonfeltets femte kraft genereres af otte tynde film (kildemasser) af polyimid med en tykkelse på 75 μm, fordelt ligeligt på en roterende plade. Kraftsensoren består -
 Plasmaflow nær solens overflade forklarer solpletter, andre solfænomenerSolpletter kan ses på dette billede af solstråling. Hver solplet varer et par dage til et par måneder, og det samlede antal topper hvert 11. år. De mørkere pletter ledsager lyse hvide pletter, kaldet
Plasmaflow nær solens overflade forklarer solpletter, andre solfænomenerSolpletter kan ses på dette billede af solstråling. Hver solplet varer et par dage til et par måneder, og det samlede antal topper hvert 11. år. De mørkere pletter ledsager lyse hvide pletter, kaldet -
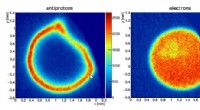 Antimaterialeundersøgelse for at drage fordel af opskrift på ti gange rumlig komprimering af plasm…Eksempel på råbilleder fra detektoren til identiske partikeloperationer med antiproton -detektion (venstre) og elektrondetektion (højre). Kredit:Springer Et internationalt team af fysikere, der st
Antimaterialeundersøgelse for at drage fordel af opskrift på ti gange rumlig komprimering af plasm…Eksempel på råbilleder fra detektoren til identiske partikeloperationer med antiproton -detektion (venstre) og elektrondetektion (højre). Kredit:Springer Et internationalt team af fysikere, der st
- Under det døde hav, advarsler om alvorlig tørke
- Forskere udvider galvaniske erstatningsreaktioner til metaloxid -nanokrystaller
- Når en væske bliver blåt lakmuspapir rød betyder dette, at det er en?
- Vagthund for at undersøge oversvømmelsesrisici for Superfund -websteder
- Forskere finder brede konsekvenser af politisk polarisering
- At opdage Sloveniens underjordiske labyrinter, en hule ad gangen


