Hvilken information går tabt, når man bruger elektronkonfigurationer i stedet for orbitaldiagrammer?
1. Orbitalformer :Elektronkonfigurationer beskriver kun antallet af elektroner i hver atomare orbital, ikke deres specifikke former eller orienteringer i rummet. Orbitaldiagrammer, på den anden side, illustrerer tydeligt formen af hver orbital ved at bruge forskellige geometriske repræsentationer, såsom cirkler, firkanter eller håndvægte.
2. Electron Spins :Elektronkonfigurationer giver ikke information om elektronspin i orbitaler. Orbitaldiagrammer viser fordelingen af elektronspin ved at placere op- og nedpile i orbitalerne. Denne information er vigtig for at forstå den overordnede elektronparring og spin-mangfoldighed af et atom eller molekyle.
3. Energiniveauer :Mens elektronkonfigurationer angiver de vigtigste energiniveauer (n) af orbitalerne fyldt med elektroner, angiver de ikke de nøjagtige energiunderniveauer (s, p, d, f) inden for disse hovedniveauer. Orbitaldiagrammer viser tydeligt opdelingen af energiunderniveauer og den tilhørende elektronfordeling.
4. Elektrondelokalisering :Elektronkonfigurationer kan ikke repræsentere elektrondelokalisering, som opstår, når elektroner er spredt ud over et større område i stedet for at være lokaliseret i specifikke orbitaler. Orbitaldiagrammer kan illustrere elektrondelokalisering ved at bruge stiplede eller stiplede linjer til at forbinde flere atomer eller orbitaler, hvor elektroner kan bevæge sig frit.
5. Molekylær symmetri og binding :Orbitaldiagrammer er kraftfulde værktøjer til at repræsentere symmetrien og bindingen i molekyler. De giver mulighed for visualisering af molekylære orbitaler, som opstår fra interaktioner mellem atomare orbitaler. Denne information er afgørende for at forstå kemisk binding og molekylers elektroniske struktur.
Generelt giver orbitaldiagrammer en mere detaljeret og visuel repræsentation af den rumlige fordeling, energiniveauer og interaktioner af elektroner inden for et atom eller molekyle, hvilket giver indsigt, der ikke er let tilgængelig fra elektronkonfigurationer alene.
 Varme artikler
Varme artikler
-
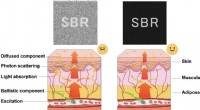 Perfektion og udvidelse af det nær-infrarøde billedvindueFormering af ophidsede ballistiske og diffuserede emissionsfoton i biovævet med lille (venstre) og moderat (højre) lysabsorption og det resulterende signal til baggrundsforhold (SBRer) af fluorescensb
Perfektion og udvidelse af det nær-infrarøde billedvindueFormering af ophidsede ballistiske og diffuserede emissionsfoton i biovævet med lille (venstre) og moderat (højre) lysabsorption og det resulterende signal til baggrundsforhold (SBRer) af fluorescensb -
 Hvor mange Orbeez skal der til for at fylde et badekar?Orbeez er farverige, squishy små perler på størrelse med kuglelejer lavet af polymerer sammensat af akrylsyre, natriumhydroxid og vand. Harper Park I år 2020 har folk sandsynligvis brugt mere tid p
Hvor mange Orbeez skal der til for at fylde et badekar?Orbeez er farverige, squishy små perler på størrelse med kuglelejer lavet af polymerer sammensat af akrylsyre, natriumhydroxid og vand. Harper Park I år 2020 har folk sandsynligvis brugt mere tid p -
 Nyt højpræcisionsinstrument muliggør hurtige målinger af proteinkrystallerYuan Gao, Wuxian Shi, Evgeny Nazaretski, Stuart Myers, Weihe Xu og, Martin Fuchs designet og implementerede det nye goniometerscannersystem til ultrahurtig og effektiv seriel proteinkrystallografi ved
Nyt højpræcisionsinstrument muliggør hurtige målinger af proteinkrystallerYuan Gao, Wuxian Shi, Evgeny Nazaretski, Stuart Myers, Weihe Xu og, Martin Fuchs designet og implementerede det nye goniometerscannersystem til ultrahurtig og effektiv seriel proteinkrystallografi ved -
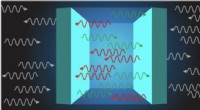 Kraften er med os, altid? Tuning af kvantevakuumkræfter fra attraktive til frastødendeASU -fysiker Frank Wilczek har for første gang vist, at Casimir -styrken kan vendes og gør frastødende, indstillelig eller forbedret, afhængigt af egenskaberne af materialet indsat mellem pladerne. Kr
Kraften er med os, altid? Tuning af kvantevakuumkræfter fra attraktive til frastødendeASU -fysiker Frank Wilczek har for første gang vist, at Casimir -styrken kan vendes og gør frastødende, indstillelig eller forbedret, afhængigt af egenskaberne af materialet indsat mellem pladerne. Kr
- Google affiliate begynder droneleverancer i Virginia by
- Hvordan cilia bliver organiseret:Forskere låser op for arkitektoniske hemmeligheder ved ciliær par…
- Forskning undersøger virkningen af koralblegning på Vest -Australiens kystlinje
- Molekylære glasfibre
- Sådan beregnes pendulkraft
- Hvordan har COVID-19 ændret superstjernebyer?


