Hvilke baner kan elektroner optage?
```
r =n^2 * h^2 / (2 * pi * m * k * e^2)
```
hvor:
* r er kredsløbets radius i meter
* n er det vigtigste kvantetal, som kan antage enhver positiv heltalværdi
* h er Plancks konstant (6,626 x 10^-34 J s)
* m er elektronens masse (9,11 x 10^-31 kg)
* k er Coulomb-konstanten (8,99 x 10^9 N m^2/C^2)
* e er den elementære ladning (1,602 x 10^-19 C)
Energien af en elektron i en bane er givet ved formlen:
```
E =-13,6 eV/n^2
```
hvor:
* E er elektronens energi i elektronvolt (eV)
* n er det vigtigste kvantetal
Når hovedkvantetallet n stiger, øges kredsløbets radius, og elektronens energi falder. Den laveste energibane er n =1 kredsløbet, som kaldes K-skallen. Den næste energibane er n =2 kredsløbet, som kaldes L-skallen. Og så videre.
Hver elektron i et atom optager en specifik orbital, som er defineret af de tre kvantetal:det primære kvantetal n, vinkelmomentet kvantetal l og det magnetiske kvantetal m. n kvantetallet bestemmer orbitalens energi, l kvantetallet bestemmer orbitalens form, og m kvantetallet bestemmer orbitalens orientering i rummet.
Elektronerne i et atom fylder orbitalerne i en bestemt rækkefølge, kaldet Aufbau-princippet. De laveste energiorbitaler fyldes først, og derefter bevæger elektronerne sig ind i højere energiorbitaler, efterhånden som atomet bliver mere komplekst.
Et atoms elektronkonfiguration er en beskrivelse af antallet og arrangementet af elektroner i atomets orbitaler. Elektronkonfigurationen kan bruges til at forudsige atomets kemiske egenskaber.
Sidste artikelHvad kaldes strømmen af elektroner gennem et materiale?
Næste artikelHvad kaldes det kontinuerlige ladningsflow?
 Varme artikler
Varme artikler
-
 Matematisk model bekræfter en korrekt forståelse af epidemiers sværhedsgradDr. Zhangs team foreslog en matematisk model til at analysere sygdomsoverførsel, adfærdsændring og informationsspredning. Kredit: Fysisk gennemgang E Et forskerhold ledet af City University of Ho
Matematisk model bekræfter en korrekt forståelse af epidemiers sværhedsgradDr. Zhangs team foreslog en matematisk model til at analysere sygdomsoverførsel, adfærdsændring og informationsspredning. Kredit: Fysisk gennemgang E Et forskerhold ledet af City University of Ho -
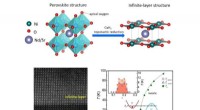 Fasediagram for uendelige lag nikkel -superledere(Top) Figur viser transformationen af perovskitstrukturen Nd1-xSrxNiO3 til den uendelige lagstruktur Nd1-xSrxNiO2 ved hjælp af calciumhydrid (CaH2). (Nederst) Figur viser højvinklet ringformet mørkf
Fasediagram for uendelige lag nikkel -superledere(Top) Figur viser transformationen af perovskitstrukturen Nd1-xSrxNiO3 til den uendelige lagstruktur Nd1-xSrxNiO2 ved hjælp af calciumhydrid (CaH2). (Nederst) Figur viser højvinklet ringformet mørkf -
 Nyt kvantestopur kan forbedre billedteknologierKredit:CC0 Public Domain Forskere ved University of Colorado Boulder har designet et af de mest præcise stopure til dato - ikke til timing af olympiske sprintere og svømmere, men for at tælle enke
Nyt kvantestopur kan forbedre billedteknologierKredit:CC0 Public Domain Forskere ved University of Colorado Boulder har designet et af de mest præcise stopure til dato - ikke til timing af olympiske sprintere og svømmere, men for at tælle enke -
 Stævner, protester, og Black Friday:Fysik finder farer, der gemmer sig ved almindeligt synBevægelser i skarer. Kredit:Fotografi af Ulrike Biets; illustration af Arianna Bottinelli, David T.J. Sumpter, og Jesse L. Silverberg Inspireret af den måde, folk bevæger sig på heavy metal -konce
Stævner, protester, og Black Friday:Fysik finder farer, der gemmer sig ved almindeligt synBevægelser i skarer. Kredit:Fotografi af Ulrike Biets; illustration af Arianna Bottinelli, David T.J. Sumpter, og Jesse L. Silverberg Inspireret af den måde, folk bevæger sig på heavy metal -konce
- Hvert sandkorn er en metropol for bakterier
- Har lys som en fjer,
- Kan fremtidens huse laves af bakterier?
- Stoffer, der er uigennemtrængelige for vand
- De fleste lande overtræder international lov under COVID-19-pandemien, siger juridiske eksperter
- Vær sød, Spol venligst tilbage:Oregon Blockbuster er sidst på jorden


