I hvilken tilstand af stof bevæger molekyler sig langsomt?
Her er hvorfor:
* faste stoffer: Molekyler i faste stoffer er tæt pakket sammen og har stærke intermolekylære kræfter. De vibrerer på plads, men har ikke nok energi til at bevæge sig frit.
* væsker: Molekyler i væsker er tættere sammen end i gasser, men længere fra hinanden end i faste stoffer. De har mere frihed til at bevæge sig rundt, så de bevæger sig hurtigere end molekyler i faste stoffer.
* Gasser: Molekyler i gasser er langt fra hinanden og bevæger sig meget hurtigt. De kolliderer med hinanden og væggene i deres beholder.
Så jo langsommere molekylerne bevæger sig, jo mere tæt pakket er de, og jo vanskeligere er det for dem at bevæge sig rundt. Dette er grunden til, at faste stoffer har en fast form og volumen, mens væsker har et fast volumen, men ikke en fast form, og gasser har hverken en fast form eller volumen.
Sidste artikelHvorfor går en tennisbold langt, hvis du kaster den?
Næste artikelHvad er span i frekvens?
 Varme artikler
Varme artikler
-
 Mod adskillelsen af kvante- og klassiske forespørgselskomplekserResultatet af 2-fold og 3-fold Forreation er vist. Kredit:© Science China Press Korrelationsfunktioner bruges ofte til at kvantificere forholdet mellem indbyrdes afhængige variabler eller datasæt.
Mod adskillelsen af kvante- og klassiske forespørgselskomplekserResultatet af 2-fold og 3-fold Forreation er vist. Kredit:© Science China Press Korrelationsfunktioner bruges ofte til at kvantificere forholdet mellem indbyrdes afhængige variabler eller datasæt. -
 Team opnår første plasma på opgraderet MAST, klar til at teste Super-X divertorTeamet på Culham Center for Fusion Energy (CCFE) i Sydøst England har meddelt pressen, at testning af plasma er begyndt på en opgradering til Mega AMP Spherical Tokamak (MAST) - en ny tilgang til opre
Team opnår første plasma på opgraderet MAST, klar til at teste Super-X divertorTeamet på Culham Center for Fusion Energy (CCFE) i Sydøst England har meddelt pressen, at testning af plasma er begyndt på en opgradering til Mega AMP Spherical Tokamak (MAST) - en ny tilgang til opre -
 En ny hjerneinspireret arkitektur kunne forbedre, hvordan computere håndterer data og fremmer AIHjerneinspireret computing ved hjælp af faseændringshukommelse. Kredit:Nature Nanotechnology/IBM Research IBM -forskere udvikler en ny computerarkitektur, bedre rustet til at håndtere øget datalas
En ny hjerneinspireret arkitektur kunne forbedre, hvordan computere håndterer data og fremmer AIHjerneinspireret computing ved hjælp af faseændringshukommelse. Kredit:Nature Nanotechnology/IBM Research IBM -forskere udvikler en ny computerarkitektur, bedre rustet til at håndtere øget datalas -
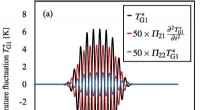 Teoretisk model, der beskriver bevægelsen af ultralydsbølger i nærværelse af flere boblerTidsudvikling af temperaturudsvinget TG1 ∗ (a) ved lydkilden (grænsetilstand) og (b) ved fokus i fig. 3 (a), hvor gassen inde i boblen er argon. De sorte, røde og blå kurver repræsenterer bølgeformern
Teoretisk model, der beskriver bevægelsen af ultralydsbølger i nærværelse af flere boblerTidsudvikling af temperaturudsvinget TG1 ∗ (a) ved lydkilden (grænsetilstand) og (b) ved fokus i fig. 3 (a), hvor gassen inde i boblen er argon. De sorte, røde og blå kurver repræsenterer bølgeformern
- Hvad er definitionen af et referencepunkt i fysisk videnskab?
- Fire grunde til, at kvantevakuumet kan forklare mørkt stof
- NASA-billeder viser fald i Kinas forurening efter virusnedlukning
- Racemikroaggressioner bidrager til uligheder i STEM-uddannelse
- Forskere bekræfter tidslinjen for menneskelig tilstedeværelse på Madagaskar
- Asparks EV laver 0 til 60 på under 2 sekunder


