Hvad er teorien om, at elektroner inden for et underniveau foretrækker at besætte deres egen orbital?
Her er en sammenbrud:
* Hunds regel: Denne regel hedder, at elektroner inden for et underskal (som P eller D) individuelt vil besætte hver orbital inden for dette underskal, før de fordobles i en enkelt orbital. Dette skyldes, at elektroner er negativt ladet og afviser hinanden.
* orbitaler: Dette er regioner af plads omkring kernen, hvor der er stor sandsynlighed for at finde en elektron. Hver orbital kan maksimalt holde to elektroner.
* underskal: En gruppe orbitaler, der har det samme energiniveau og form. F.eks. Har P -underskalet tre orbitaler (PX, PY, PZ), som hver kan indeholde to elektroner.
Hvorfor forekommer Hunds regel?
* minimering af elektronelektron frastødning: Elektroner er negativt ladet og afviser hinanden. Ved at besætte separate orbitaler inden for et underskal kan elektroner maksimere afstanden mellem dem, hvilket reducerer deres elektrostatiske frastødelse.
* Maksimering af spin -mangfoldighed: Elektroner har en egenskab kaldet spin, som enten kan spin op eller spin ned. Hunds regel dikterer, at elektroner vil besætte orbitaler med den samme spin, før de parrer sig med modsatte spins. Dette fører til en tilstand med en højere spin -mangfoldighed (mere uparrede elektroner), som generelt er mere stabil.
Eksempel:
Overvej nitrogenatomet, der har 7 elektroner. Dens elektroniske konfiguration er 1S² 2s² 2p³. Subshellet 2p har tre orbitaler. I henhold til Hunds regel vil de tre elektroner i underskalet 2p besætte hver af de tre orbitaler individuelt med parallelle spins, før de fordobles i en orbital.
Denne regel er grundlæggende for at forstå atomernes opførsel og deres interaktion. Det hjælper os med at forudsige den elektroniske konfiguration af atomer, forstå deres reaktivitet og forklare egenskaberne ved molekyler.
 Varme artikler
Varme artikler
-
 Overbevisende beviser for små dråber perfekt væskeHvis kollisioner mellem små projektiler - protoner (p), deuteroner (d), og helium-3 kerner (3He) - og guldkerner (Au) skaber bittesmå varme pletter af kvark-gluon plasma, partikelmønsteret optaget af
Overbevisende beviser for små dråber perfekt væskeHvis kollisioner mellem små projektiler - protoner (p), deuteroner (d), og helium-3 kerner (3He) - og guldkerner (Au) skaber bittesmå varme pletter af kvark-gluon plasma, partikelmønsteret optaget af -
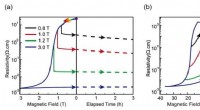 Forskere opdager den fysiske oprindelse af elektroniske faseadskillelsesfænomener i komplekse oxide…Lavtemperatur magnetoresistans efter nul-felt køling. (a) Legeringsfilmens magnetoresistens ved 10 K efter afkøling uden nul. (b) Samme proces som i A, men for den bestilte film på 0,38 K. Kredit:MIAO
Forskere opdager den fysiske oprindelse af elektroniske faseadskillelsesfænomener i komplekse oxide…Lavtemperatur magnetoresistans efter nul-felt køling. (a) Legeringsfilmens magnetoresistens ved 10 K efter afkøling uden nul. (b) Samme proces som i A, men for den bestilte film på 0,38 K. Kredit:MIAO -
 Sjælden kvantecomputer med åben adgang nu i driftSandia National Laboratories fysiker Susan Clark leder teamet, der byggede Quantum Scientific Computing Open User Testbed. Den ionbaserede kvantecomputer blev lavet til eksterne forskere at bruge. Kre
Sjælden kvantecomputer med åben adgang nu i driftSandia National Laboratories fysiker Susan Clark leder teamet, der byggede Quantum Scientific Computing Open User Testbed. Den ionbaserede kvantecomputer blev lavet til eksterne forskere at bruge. Kre -
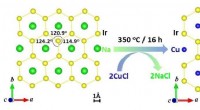 En kvante -centrifugeringsvæske:Honeycomb -gitter opfylder undvigende standarder for Kitaev -modell…Forskere fra Boson College og Harvard vendte sig til kobber for at skabe et første af sin slags iridat-Cu2IrO3-hvor den naturlige magnetiske orden forstyrres, en tilstand kendt som geometrisk frustrat
En kvante -centrifugeringsvæske:Honeycomb -gitter opfylder undvigende standarder for Kitaev -modell…Forskere fra Boson College og Harvard vendte sig til kobber for at skabe et første af sin slags iridat-Cu2IrO3-hvor den naturlige magnetiske orden forstyrres, en tilstand kendt som geometrisk frustrat
- Økonomer advarer om omfattende omkostninger ved lockdown
- Sporbare og styrede nanomissiler leverer kræftbekæmpende lægemiddel direkte til tumoren
- Terradynamics:Teknik kan hjælpe designere med at forudsige, hvordan robotter med ben vil bevæge si…
- NASA analyserer den tropiske cyklon Damiens vanddampkoncentration
- Undersøgelse afslører, at tre fjerdedele af befolkningen er utilfredse med politiske partier
- Hvor mange ml i 650 mg tylenol?


