Hvad er elementet, der har maksimal ikke -metallisk karakter?
Her er hvorfor:
* Elektronegativitet: Fluor har den højeste elektronegativitet af alle elementer. Elektronegativitet er et atomens tendens til at tiltrække elektroner mod sig selv i en kemisk binding. Jo højere elektronegativitet, jo mere ikke-metallisk er elementet.
* ioniseringsenergi: Fluor har også en meget høj ioniseringsenergi, som er den energi, der kræves for at fjerne et elektron fra et neutralt atom. Denne høje energi indikerer et stærkt greb på dens elektroner og understøtter yderligere dens ikke-metalliske karakter.
* Elektronaffinitet: Fluor har en høj elektronaffinitet, hvilket betyder, at den let får elektroner. Dette er et andet kendetegn ved ikke-metaler.
Kortfattet: Fluorens ekstraordinære elektronegativitet, høj ioniseringsenergi og høj elektronaffinitet gør det til det mest ikke-metalliske element i den periodiske tabel.
 Varme artikler
Varme artikler
-
 Skub grænsen for tyndfilmsabsorption i sol- og vandopdelingsapplikationerKredit:Rensselaer Polytekniske Institut En siliciumsolcelle høster solens energi, når lyset rejser ned gennem lysabsorberende silicium. For at reducere vægt og omkostninger, solceller er tynde, og
Skub grænsen for tyndfilmsabsorption i sol- og vandopdelingsapplikationerKredit:Rensselaer Polytekniske Institut En siliciumsolcelle høster solens energi, når lyset rejser ned gennem lysabsorberende silicium. For at reducere vægt og omkostninger, solceller er tynde, og -
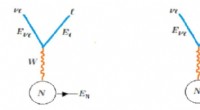 Sondering af højenergineutrinoer forbundet med en blazarDiagrammer for ladet (venstre) og neutral (højre) strøm neutrino-nukleon interaktion. Bevarelse af energi kræverEν=Eℓ+ EN. Tidsflow er fra venstre mod højre. Kredit:The European Physical Journal Plus
Sondering af højenergineutrinoer forbundet med en blazarDiagrammer for ladet (venstre) og neutral (højre) strøm neutrino-nukleon interaktion. Bevarelse af energi kræverEν=Eℓ+ EN. Tidsflow er fra venstre mod højre. Kredit:The European Physical Journal Plus -
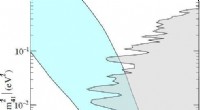 Søger efter sub-eV sterile neutrinoer ved hjælp af to meget følsomme detektorerKredit:RENO Samarbejde. Standardmodellen for partikelfysik tegner sig kun for 20% af stoffet i universet. Fysikere har teoretiseret, at de resterende 80% består af såkaldt mørkt stof, som består a
Søger efter sub-eV sterile neutrinoer ved hjælp af to meget følsomme detektorerKredit:RENO Samarbejde. Standardmodellen for partikelfysik tegner sig kun for 20% af stoffet i universet. Fysikere har teoretiseret, at de resterende 80% består af såkaldt mørkt stof, som består a -
 Forskere bevæger sig tættere på praktisk fotonisk kvanteberegningKredit:CC0 Public Domain For første gang, forskere har demonstreret en måde at kortlægge og måle storskala fotonisk kvantekorrelation med enkelt-foton følsomhed. Evnen til at måle tusindvis af for
Forskere bevæger sig tættere på praktisk fotonisk kvanteberegningKredit:CC0 Public Domain For første gang, forskere har demonstreret en måde at kortlægge og måle storskala fotonisk kvantekorrelation med enkelt-foton følsomhed. Evnen til at måle tusindvis af for
- Undersøgelse afslører en ny mekanisme bag epilepsi og lægemiddelmodulering
- Ny nanoteknologisk opfindelse forbedrer effektiviteten af kræftpenicillinet
- Forskere vurderer, hvor store dinosaurer virkelig kan blive
- Forsker:Jeg interviewede mødre med fem eller flere børn - hvad jeg lærte om kvinder, der stille o…
- Hvad er en primær amin?
- Voldskriminaliteten er stigende. Hvad kan byer gøre?


