Når 2 molekyler af et fast stof holdes en vis afstand fra hinanden, og kraften mellem dem måles, smeltes derefter til dannelse af væske. To nu samme kraft?
* Stater for stof og intermolekylære kræfter: Forskellen i kraft mellem de to molekyler opstår fra de forskellige tilstande af stof, fast og flydende og arten af intermolekylære kræfter.
* solid tilstand: I en fast er molekyler tæt pakket og holdes sammen af stærke intermolekylære kræfter. Disse kræfter kan være:
* ioniske bindinger: Stærke elektrostatiske kræfter mellem modsat ladede ioner.
* kovalente obligationer: Stærk deling af elektroner mellem atomer.
* Hydrogenbindinger: Stærke dipol-dipolinteraktioner, der involverer brint.
* van der Waals Forces: Svage attraktioner på grund af midlertidige udsving i elektronfordelingen.
* flydende tilstand: I en væske er molekylerne mere løst pakket, og de intermolekylære kræfter er svagere. Mens nogle af de kræfter, der er til stede i fast tilstand, kan fortsætte, er de mindre effektive på grund af den øgede afstand og fri bevægelighed mellem molekyler.
* smeltning: Når en solid smelter, overvinder den øgede termiske energi de stærke intermolekylære kræfter, der holder molekylerne i et fast gitter. Dette får molekylerne til at bryde fri fra deres stive struktur og bevæge sig mere frit, hvilket resulterer i en mindre ordnet tilstand med svagere interaktioner.
Derfor vil kraften mellem to molekyler være svagere i den flydende tilstand sammenlignet med fast tilstand. Denne forskel i intermolekylære kræfter er det, der definerer de forskellige egenskaber ved faste stoffer (fast form, stiv) og væsker (væske, tager formen på dens beholder).
 Varme artikler
Varme artikler
-
 Fornyet design kunne tage kraftige biologiske computere fra reagensglasset til cellenNIST-forskere sigter mod at forvandle cellen til en biologisk computerfabrik ved at designe og indsætte DNA i en celles genom. Celleproteiner ville producere RNA baseret på DNAet gennem transkription.
Fornyet design kunne tage kraftige biologiske computere fra reagensglasset til cellenNIST-forskere sigter mod at forvandle cellen til en biologisk computerfabrik ved at designe og indsætte DNA i en celles genom. Celleproteiner ville producere RNA baseret på DNAet gennem transkription. -
 Kvantefriktion - ud over den lokale ligevægtstilnærmelseSkematisk repræsentation af forskellen mellem den lokale termiske ligevægtstilnærmelse (a) og den fulde ikke-ligevægtsbeskrivelse (b) for kvantefriktion. I det første tilfælde antages det, at atomet o
Kvantefriktion - ud over den lokale ligevægtstilnærmelseSkematisk repræsentation af forskellen mellem den lokale termiske ligevægtstilnærmelse (a) og den fulde ikke-ligevægtsbeskrivelse (b) for kvantefriktion. I det første tilfælde antages det, at atomet o -
 Verdens største røntgenlaser genererer sit første laserlysDet første laserlys på det europæiske XFEL, optaget af en røntgendetektor i enden af tunnelen. Kredit:DESY Den europæiske XFEL, den største røntgenlaser i verden, har nået den sidste store milep
Verdens største røntgenlaser genererer sit første laserlysDet første laserlys på det europæiske XFEL, optaget af en røntgendetektor i enden af tunnelen. Kredit:DESY Den europæiske XFEL, den største røntgenlaser i verden, har nået den sidste store milep -
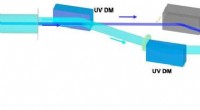 Udforsker forholdet mellem attosecond optisk interferens og attosecond kvanteinterferensInterferometeret, der leverer det sammenhængende HH-pulspar og TH-probeimpulsen. Kredit:Ultrafast Science Et forskerhold fra RIKEN Center for Advanced Photonics og University of Tokyo har udviklet
Udforsker forholdet mellem attosecond optisk interferens og attosecond kvanteinterferensInterferometeret, der leverer det sammenhængende HH-pulspar og TH-probeimpulsen. Kredit:Ultrafast Science Et forskerhold fra RIKEN Center for Advanced Photonics og University of Tokyo har udviklet
- Styring af zeolitporenes indre til kemo-selektive alkyn/olefin-separationer
- Lysbølgedrevet scanning tunneling spektroskopi af atomisk præcise grafen nanobånd
- Undersøgelse viser, at autonome køretøjer kan hjælpe med at forbedre trafikken
- Forskere bygger en enzym-opdagende AI
- Nævn nogle af de mest sure væsker eller stoffer, der findes i hverdagen.?
- Hvordan planter hurtigt tilpasser sig skiftende miljøforhold


