Hvad er målet for, hvor hurtigt en reaktion finder sted?
Her er en sammenbrud:
* reaktionshastighed Henviser til ændringen i koncentration af reaktanter eller produkter pr. Enhedstid.
* Det fortæller os, hvor hurtigt en reaktion fortsætter.
* En højere reaktionshastighed betyder, at reaktionen sker hurtigere, mens en lavere reaktionshastighed betyder, at den sker langsommere.
Faktorer, der påvirker reaktionshastigheden inkluderer:
* Temperatur: Højere temperaturer fører generelt til hurtigere reaktioner.
* Koncentration: Højere koncentrationer af reaktanter fører til hurtigere reaktioner.
* overfladeareal: For reaktioner, der involverer faste stoffer, fører et større overfladeareal udsat for reaktanter til hurtigere reaktioner.
* katalysator: En katalysator fremskynder en reaktion uden at blive fortæret selv.
* Natur af reaktanter: Nogle reaktanter reagerer lettere end andre.
Måling af reaktionshastighed:
* indledende hastighedsmetode: Denne metode måler reaktionshastigheden helt i begyndelsen, før reaktanternes koncentrationer har ændret sig markant.
* Integrerede hastighedslovgivning: Disse ligninger beskriver, hvordan koncentrationen af reaktanter ændrer sig over tid.
* spektrofotometri: Denne teknik måler absorbansen af lys ved reaktionsblandingen, som kan bruges til at bestemme koncentrationen af reaktanter eller produkter.
Forståelse af reaktionshastighed er afgørende inden for forskellige områder, herunder kemi, biologi og teknik.
 Varme artikler
Varme artikler
-
 Superbrændstoffer kan fusionere via proptrækkerKredit:CC0 Public Domain Forskere ved Florida State University med hovedkontor i National High Magnetic Field Laboratory har fundet en opdagelse i væskedynamik, der virkelig er værd at fjerne en f
Superbrændstoffer kan fusionere via proptrækkerKredit:CC0 Public Domain Forskere ved Florida State University med hovedkontor i National High Magnetic Field Laboratory har fundet en opdagelse i væskedynamik, der virkelig er værd at fjerne en f -
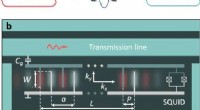 En fononisk krystal koblet til en transmissionslinje via et kunstigt atomEnheden. (a) Skema af enheden. Det kunstige atom er samtidigt koblet til elektromagnetiske og akustiske systemer. Mikrobølge -fotoner ophidser et kunstigt atom (qubit). Atomet genererer igen fononer t
En fononisk krystal koblet til en transmissionslinje via et kunstigt atomEnheden. (a) Skema af enheden. Det kunstige atom er samtidigt koblet til elektromagnetiske og akustiske systemer. Mikrobølge -fotoner ophidser et kunstigt atom (qubit). Atomet genererer igen fononer t -
 Spin holder elektroner på linje i jernbaseret superlederResonant uelastisk røntgenspredning afslører højenergiske nematiske spin-korrelationer i den nematiske tilstand af den jernbaserede superleder, FeSe. Billede:Beijing Normal University/Qi Tang og Xingy
Spin holder elektroner på linje i jernbaseret superlederResonant uelastisk røntgenspredning afslører højenergiske nematiske spin-korrelationer i den nematiske tilstand af den jernbaserede superleder, FeSe. Billede:Beijing Normal University/Qi Tang og Xingy -
 Hvad hvis jeg lægger aluminiumsfolie i mikrobølgeovnen?Denne mand smiler muligvis, da han lægger aluminiumsfolien i mikrobølgeovnen, men han smiler ikke længe. Glowimages/Getty Images Mikrobølgeovnen er en af de store opfindelser i det 20. århundrede -
Hvad hvis jeg lægger aluminiumsfolie i mikrobølgeovnen?Denne mand smiler muligvis, da han lægger aluminiumsfolien i mikrobølgeovnen, men han smiler ikke længe. Glowimages/Getty Images Mikrobølgeovnen er en af de store opfindelser i det 20. århundrede -
- EPA giver Florida -forsyningsselskaber fritagelse for forurening efter Irma
- Hvad gør videnskabelige teorier?
- Er reaktionshastigheden påvirket af mængdeenzym i miljøet?
- Hvor er det synlige lys sted i elektromagnetisk spektrum?
- Hvad er produkterne til fotosyntesen?
- Ny metode øger energitætheden i lithium-batterier


