Cryo-elektronmikroskopi opnår en hidtil uset opløsning ved hjælp af nye beregningsmetoder

Komplet kapsid af bakteriofag P22 genereret med validerede atommodeller, der blev afledt af et højopløsnings kryo-elektronmikroskopi tæthedskort. Kredit:C. Hryc og Chiu Lab, Baylor College of Medicine
Kryo-elektronmikroskopi (cryo-EM) - som muliggør visualisering af vira, proteiner, og andre biologiske strukturer på molekylært niveau - er et kritisk værktøj, der bruges til at fremme biokemisk viden. Nu har forskere fra Lawrence Berkeley National Laboratory (Berkeley Lab) udvidet cryo-EM's virkning yderligere ved at udvikle en ny beregningsalgoritme, der var medvirkende til at konstruere en 3-D atomskala model af bakteriofag P22 for første gang.
Over 20, 000 todimensionale kryo-EM-billeder af bakteriofag P22 (også kendt som P22-virus, der inficerer den almindelige bakterie Salmonella) fra Baylor College of Medicine blev brugt til at lave modellen. Resultaterne blev offentliggjort af forskere fra Baylor College of Medicine, Massachusetts Tekniske Institut, Purdue University og Berkeley Lab i Procedurer fra de nationale videnskabsakademier tidligere i marts.
"Dette er et godt eksempel på, hvordan man udnytter elektronmikroskopi-teknologi og kombinerer den med nye beregningsmetoder til at bestemme en bakteriofags struktur, " sagde Paul Adams, Berkeley Labs afdelingsdirektør for Molecular Biophysics &Integrated Bioimaging og medforfatter til papiret. "Vi udviklede algoritmerne - beregningskoden - for at optimere atommodellen, så den bedst passer til de eksperimentelle data."
Pavel Afonine, en Berkeley Labs beregningsforsker og medforfatter af papir, tog føringen i udviklingen af algoritmen ved hjælp af Phenix, en softwarepakke, der traditionelt anvendes i røntgenkrystallografi til bestemmelse af makromolekylære strukturer.
Den vellykkede gengivelse af bakteriofag P22s 3-D atomskala-model giver forskere mulighed for at kigge inde i virusets proteinfrakker ved opløsning. Det er kulminationen på flere års arbejde, der tidligere havde gjort det muligt for Baylor College -forskere at spore det meste af proteinets rygrad, men ikke de fine detaljer, ifølge Corey Hryc, co-første forfatter og en kandidatstuderende af Baylor biokemi professor Wah Chiu.
"Takket være denne udsøgte strukturelle detalje, vi har bestemt proteinkemien for P22-virussen, " sagde Chiu. "Jeg tror, det er vigtigt, at vi giver detaljerede annotationer med strukturen, så andre forskere kan bruge den til deres fremtidige eksperimenter, "tilføjede han. Chius laboratorium har brugt kryo-EM og computerrekonstruktionsteknikker til at bygge 3D-molekylære strukturer i næsten 30 år.
Og resultaterne kan også have værdifulde biologiske implikationer.
Takket være 3D-modellen i atomskala, det er nu "muligt at se interaktionerne mellem stykkerne, der udgør P22 -virussen, som er afgørende for at gøre det stabilt, " sagde Adams. Dette hjælper forskerne med at finde ud af, hvordan man laver kemikalier, der kan binde sig til visse proteiner. Adams understreger, at evnen til at forstå atomernes konfiguration i molekylært rum kan bruges til at generere ny indsigt i lægemiddeldesign og -udvikling.
Sidste artikelRegistrering af skadelige molekyler med lys
Næste artikelMikrober kunne gøre medicinproduktionen mere effektiv
 Varme artikler
Varme artikler
-
 Hvad er en syntesereaktion?Spiste du en syntesereaktion til morgenmaden? Det er meget sandsynligt, hvis du indtager taurin, som er resultatet af en organisk syntesereaktion og ofte findes i mælk og æg. I kemi er en syntesere
Hvad er en syntesereaktion?Spiste du en syntesereaktion til morgenmaden? Det er meget sandsynligt, hvis du indtager taurin, som er resultatet af en organisk syntesereaktion og ofte findes i mælk og æg. I kemi er en syntesere -
 Porøst materiale gør det muligt for autonome undervandsbiler at rejse videreKredit:CC0 Public Domain Da de fleste autonome undervandsbiler skal bære deres egen energi, når de arbejder under vand, variable metoder bruges normalt til at forbedre udholdenhed, såsom elektroni
Porøst materiale gør det muligt for autonome undervandsbiler at rejse videreKredit:CC0 Public Domain Da de fleste autonome undervandsbiler skal bære deres egen energi, når de arbejder under vand, variable metoder bruges normalt til at forbedre udholdenhed, såsom elektroni -
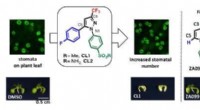 Flere mund kan fodres ved at øge antallet af plantens porerForbindelser, der øger antallet af stomata på planter. Kredit:Nagoya University Miljøundersøgelser har vist, at 40% af det atmosfæriske kuldioxid (CO2) passerer hvert år gennem plantemateriale. De
Flere mund kan fodres ved at øge antallet af plantens porerForbindelser, der øger antallet af stomata på planter. Kredit:Nagoya University Miljøundersøgelser har vist, at 40% af det atmosfæriske kuldioxid (CO2) passerer hvert år gennem plantemateriale. De -
 Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f
Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f
- Trusselsintelligens computing til effektiv jagt på cybertrusler
- 15 gange stærkere end stål:Forskere udvikler sig stærkest, verdens letteste glas nanofibre
- Liste over insekter, der spiser dødt kød
- Siliciumgennembrud kan føre til ny højtydende bøjelig elektronik
- Finansielle omkostninger forbundet med landmænd risikerer at tage
- Sådan beregnes nettovægt


