En ny tilgang til at amplificere DNA
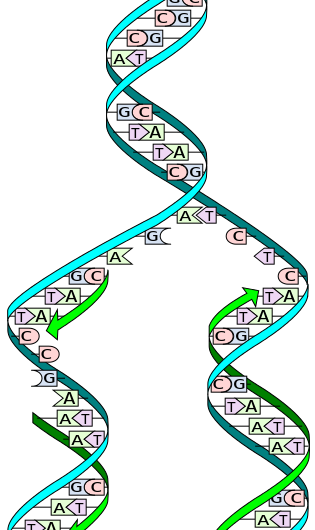
Under replikation, de to strenge er adskilt. Hver streng af det originale DNA-molekyle tjener derefter som skabelon til produktionen af dets komplementære modstykke. Kredit:Wikimedia Commons
Analyse af DNA er nyttig til en række vitale applikationer. Dette omfatter diagnosticering og overvågning af sygdomme, identifikation af kriminelle, og studere funktionen af et målrettet segment af DNA. Imidlertid, Metoder, der anvendes til analyser, kræver ofte mere DNA, end der kan være tilgængeligt i en typisk prøve. 'Derfor, forstærkning er nødvendig, men ikke altid ligetil. Den mest udbredte amplifikations- eller fotokopieringsmetode er polymerasekædereaktionen (PCR). En ny PCR-metode kunne hjælpe amplifikationsprocessen, og dermed udvikle robuste assays, som tidligere ikke ville have været mulige.
Deoxyribonukleinsyre (DNA) er et molekyle, der findes i cellekernen og bærer 'instruktionerne' for levende organismers udvikling og funktion. Det sammenlignes ofte med et sæt tegninger, da det indeholder de instruktioner, der er nødvendige for at bygge celler. Disse instruktioner er opdelt i segmenter langs en DNA-streng.
Replikation
DNA består af en dobbelt helix af to komplementære strenge lavet af nukleotider, en struktur, der ofte sammenlignes med en stige. Når det er tid til at replikere, de to DNA-strenge – eller 'sider' af stigen- vikles ud og adskilles. Et enzym kaldet DNA-polymerase læser de individuelle strenge og matcher komplementære baser - stigens 'trin' - med den oprindelige streng. Nye strenge produceres på begge sider af det originale DNA, at lave to identiske DNA-dobbeltspiraler sammensat af en original og en ny streng. Denne proces forekommer i alle levende organismer og er grundlaget for biologisk arv.
PCR
Replikation kan også behandles kunstigt. Nogle gange kaldet "molekylær fotokopiering, "polymerasekædereaktionen (PCR) er en hurtig og relativt billig teknik, der bruges til at amplificere, eller lave mange kopier af, små dele af DNA. Dette er nødvendigt, fordi metoder, der anvendes til at analysere DNA eller bestemme DNA-baseparsekvensen, kræver mere DNA, end der kan være i en typisk prøve. Derfor, Målet med PCR er at amplificere en specifik region af en DNA-streng.
For at udføre PCR, de to strenge af DNA-dobbelthelixen adskilles fysisk ved at anvende høj temperatur (93-98 °C) i en proces, der kaldes DNA-smeltning. I andet trin, temperaturen sænkes og de to DNA-strenge, nu adskilt, blive skabeloner til såkaldte primere. Primere er korte enkeltstrengede DNA-molekyler, komplementær til DNA-regionen målrettet for amplifikation. Efter at have sænket temperaturen, primerne tilføjet til PCR-processen finder og binder til dets specifikke mål. Et enzym kaldet DNA-polymerase vil forlænge - eller bygge - en ny DNA-streng fra primeren ved at bruge det underliggende enkeltstrengede DNA-molekyle som skabelon.
At bygge en stige
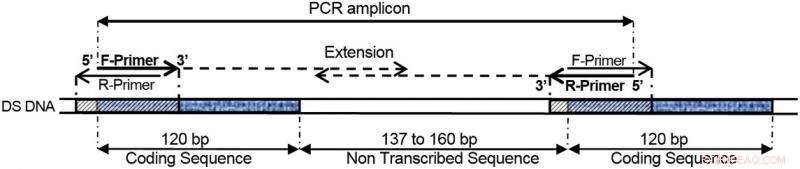
COMPAS-PCR ved hjælp af meget komplementære primere anvendt på 5S ribosomalt DNA direkte gentagelsesgener, som vist i dette eksempel. Kredit:Norsk Institut for Vandforskning (NIVA)
Som nævnt ovenfor, primere er korte enkeltstrengede DNA-molekyler. Disse er normalt omkring 20 nukleotider lange. Denne streng af nukleotider, knytter sig specifikt til begyndelsen af skabelonstrengen ved baseparring - at finde de komplementære baser. DNA-polymerase er derefter i stand til at tilføje det næste komplementære nukleotid. Polymerasen fortsætter med at tilføje flere komplementære nukleotider til template-DNA'et, indtil en ny dobbeltstreng af DNA er færdiggjort, eller for at bruge metaforen ovenfor; en ny stige er bygget, med en original side og en ny side.
Dobbelte primere gør det muligt præcist at definere området af et DNA-molekyle, der skal amplificeres af PCR. Disse to flankerende primere angiver, hvor den nye kæde skal begynde og slutte.
Et lille paradigmeskifte
En central regel, der er stærkt forankret i molekylærforskerens sind, er, at primere kun skal være komplementære til målsekvensen, og ikke med hinanden. Dette for at undgå, at primere bruger hinanden som skabeloner og dermed deaktiverer yderligere mulig involvering i traditionel målamplifikation.
I en nylig undersøgelse, offentliggjort i det videnskabelige tidsskrift PLOS One , Seniorforsker Marc Anglès d´Auriac fra Norsk Institut for Vandforskning (NIVA) viser, at det er muligt at bruge meget komplementære primere og alligevel undgå de uheldige konsekvenser nævnt ovenfor. Den nye metode har fået navnet COMPAS-PCR, forkortelse for COMplementary Primer Asymmetric PCR.
Kort sagt, Anglès d'Auriac observerede, at primere, der er komplementære mellem dem selv og et mål (triple overlay) stadig kunne definere et amplifikationsprodukt, når de er en del af et gentaget DNA-motiv eller -struktur. Dette er vist i figuren nedenfor. Yderligere, den fysiske hindring af målamplifikation på grund af primerkomplementaritet blev lindret ved at indføre asymmetriske primerkoncentrationer. Asymmetrisk betyder i denne henseende ulige antal molekyler mellem de to primere. En primer består af et lavt antal molekyler, den anden med et højt tal.
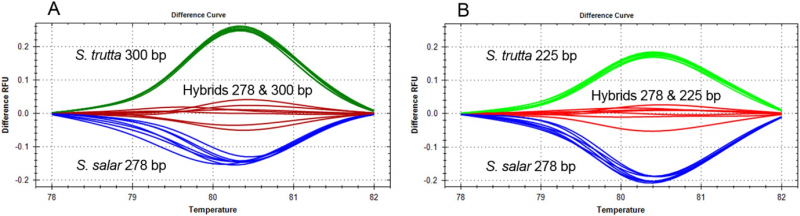
Høj opløsning smelteanalyse af to tre-primer duplex COMPAS-PCR til differentiering af S. salar, S. trutta og hybrider. Kredit:Norsk Institut for Vandforskning (NIVA)
"Hvis du bruger lige store koncentrationer, som du plejer til PCR, primerne, til stede i lige store mængder, vil holde sig til hinanden, " siger Anglès d'Auriac.
"Med asymmetriske koncentrationer, den overskydende eller højkoncentrerede primer har et antal molekyler, der ikke sidder fast med den begrænsende primer, og er derfor tilgængelig for målforstærkning."
Arbejder alene
"Denne kontraintuitive tilgang vil isolere, men også beskytte, primeren med lav koncentration, " siger Anglès d'Auriac.
Når den begrænsende primer sidder fast, og dermed beskyttet, det er muligt for primeren med høj koncentration at virke alene, det er, lave en enkeltstrenget kopi af DNA-målet. Når der produceres tilstrækkelige enkeltstrengede amplikoner, de kan tjene som skabelonmateriale til lavkoncentrationsprimeren. Den begrænsende primer frigives, og reaktionen skifter til klassisk eksponentiel PCR-amplifikation.
"Dette udvider PCR-applikationsmulighederne for videnskabsmanden, Anglès d'Auriac belyser."
Gentagne strukturer
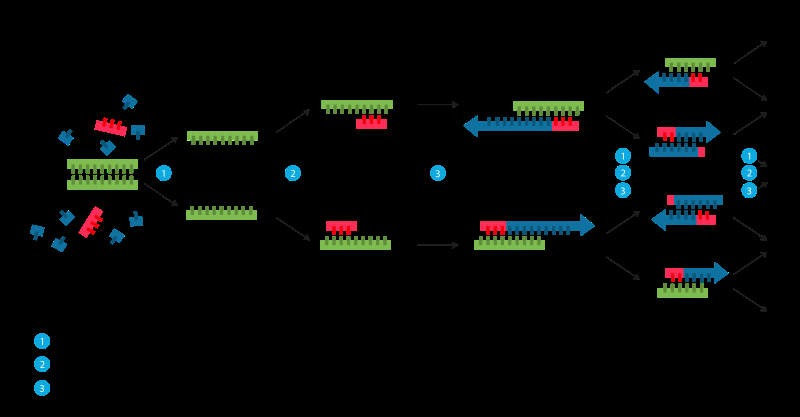
Polymerasekædereaktion (PCR). Kredit:Wikimedia
I mange organismer, en betydelig del af det genomiske DNA er meget repetitivt, med over halvdelen af sekvensen bestående af gentagne elementer hos mennesker.
Det var i sandhed en gentagen DNA-struktur, der fik Anglès d'Auriac til at tænke ud af boksen og fremsætte COMPAS-PCR princippet, et lille paradigmeskifte inden for molekylær fotokopiering.
I processen med at udføre DNA-baseret diagnose for laksefisk, især identifikation af de nært beslægtede ørreder (Salmo trutta) og atlanterhavslaks (Salmo salar), Anglès d'Auriac kæmpede for at adskille disse arter – inklusive hybrider mellem dem. Hurtig og nøjagtig identifikation vil hjælpe med at forbedre overvågningen og undersøgelser af flodøkosystemer, da identifikation af hybrider er vigtig for at estimere den økologiske sundhed i vandløbsoplande. Efter brug af COMPAS-PCR, Anglès d'Auriac var i stand til at anvende en PCR-produktanalysemetode kaldet højopløsningssmelteanalyse til identifikation af havørreder, Atlanterhavslaks og deres hybrider i én test.
Anglès d'Auriac understreger dog, at COMPAS-PCR-princippet ikke er begrænset til identifikation af fiskearter. Brug af næsten fuldstændigt komplementære primere, der målretter mod den samme sekvens, kan gælde for alle kopier, der ligger ved siden af hinanden, i DNA-motiver af interesse som målsekvenser.
"DNA-gentagelsessekvenser er rapporteret at omfatte mere end 50 % af det menneskelige genom og er til stede i mange "husholdnings"-genfamilier, såsom det 5S ribosomale gen, der blev brugt i denne undersøgelse. de generelle COMPAS-PCR-principper vil hjælpe med at udvikle nye DNA-amplifikationsstrategier ved at udnytte disse gentagne DNA-strukturer, " slutter Marc Anglès d'Auriac.
 Varme artikler
Varme artikler
-
 Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl
Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl -
 Udstyrelse af T -celleceptorer til bekæmpelse af en udbredt og undertiden dødelig virusT-celler er dygtige til at dræbe cytomegalovirus (CMV)-inficerede celler i kraft af en T-cellereceptor (TCR), der genkender intracellulære CMV-associerede proteiner, der bliver præsenteret på celleove
Udstyrelse af T -celleceptorer til bekæmpelse af en udbredt og undertiden dødelig virusT-celler er dygtige til at dræbe cytomegalovirus (CMV)-inficerede celler i kraft af en T-cellereceptor (TCR), der genkender intracellulære CMV-associerede proteiner, der bliver præsenteret på celleove -
 En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri
En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri -
 Ionvindteknologiens gennembrud tager flugtenGennembrudsflyvning -- Adrian Ieta, fra SUNY Oswegos fakultet for elektro- og computeringeniør, og SUNY Research Foundation har ansøgt om patent på teknologi, der resulterede i en første af sin slags
Ionvindteknologiens gennembrud tager flugtenGennembrudsflyvning -- Adrian Ieta, fra SUNY Oswegos fakultet for elektro- og computeringeniør, og SUNY Research Foundation har ansøgt om patent på teknologi, der resulterede i en første af sin slags
- De flygtige processer, der formede Jorden
- Billede:HiRISE ser Curiosity rover ved Mars Woodland Bay
- Amazon har 37, 000 jobannoncer - måske den mest nogensinde - over hele kloden
- Alkalisk Vs. Basic
- Sjældne jordelementer og gamle miner giver problemer for de vestlige amerikanske vandforsyninger
- Skoler lukker midt i sundhedsmæssige nødsituationer, da smogtæpper indias hovedstad


