Udstyrelse af T -celleceptorer til bekæmpelse af en udbredt og undertiden dødelig virus
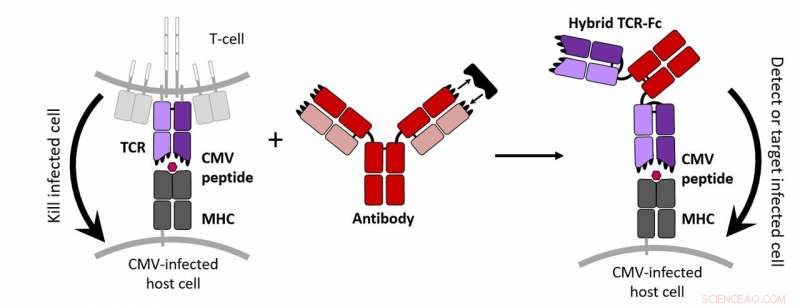
T-celler er dygtige til at dræbe cytomegalovirus (CMV)-inficerede celler i kraft af en T-cellereceptor (TCR), der genkender intracellulære CMV-associerede proteiner, der bliver præsenteret på celleoverfladen. Derimod antistoffer flyder frit gennem kroppen, binder tæt til udskillede og membranproteiner og mærker dem til genkendelse af andre immunceller. Dette arbejde kombinerede cellemålegenskaberne af en TCR og den tætte binding af et antistof med andre modifikationer for at skabe et nyt molekyle i stand til at detektere og mærke CMV-inficerede celler. Dette hybridprotein repræsenterer en ny strategi til at identificere og muligvis eliminere CMV-inficerede celler. Kredit:Jennifer Maynard/Ellen Wagner/University of Texas
Forskere har konstrueret "antistoflignende" T-celleceptorer, der specifikt kan holde sig til celler inficeret med cytomegalovirus, eller CMV, en virus, der forårsager livslang infektion hos mere end halvdelen af alle voksne ved 40 års alderen. Disse receptorer repræsenterer en ny potentiel behandlingsmulighed, kunne hjælpe med udviklingen af CMV-vacciner og kan også bruges til at målrette hjernetumorer.
I det sunde immunsystem, CMV ligger i dvale, da T-celler cirkulerer gennem kroppen og detekterer inficerede celler. Mens antistoffer kun genkender proteiner på overfladen af celler, T-celler bruger deres membranbundne T-cellereceptorer, eller TCR'er, at opdage sygdomsassocierede proteiner, der gemmer sig inde i cellemembranen. TCR'er kan derefter fortælle T-celler at ødelægge den inficerede celle, hvilket normalt er tilfældet med CMV. Imidlertid, for immunkompromitterede patienter, denne forsvarsmekanisme formindskes kraftigt, og virussen kan blive livstruende.
Forskere har brugt T-celler til at behandle sygdomme før, men konstruktion og transplantation af hele T-celler er både dyrt og invasivt. I en ny undersøgelse offentliggjort i Journal of Biological Chemistry , et team af ingeniører tog en alternativ tilgang, producerer CMV-detekterende TCR'er, der, som antistoffer, flyder frit gennem kroppen og binder sig tæt til deres syge mål.
"Lige nu har vi et molekyle, der ligner et antistof, men det binder til et (CMV-associeret) peptid, som normalt ville blive genkendt af en TCR, " sagde Jennifer Maynard, en professor i kemiteknik ved University of Texas i Austin og seniorforfatter af undersøgelsen. "Antistoffer kan normalt ikke få adgang til disse molekyler, så det er en stor sag."
For at producere terapeutiske biomolekyler, forskere bruger ofte bakterie- eller gærceller som miniaturefabrikker. Imidlertid, disse celletyper har haft minimal succes med at generere stabile humane TCR'er. Fordi receptorerne udviklede sig i pattedyrsceller, fremmede celletypers molekylære maskineri introducerer ofte defekter, sagde Maynard. For at give TCR'erne et mere passende miljø, forfatterne brugte æggestokceller fra kinesisk hamster.
"Disse proteiner er virkelig svære at arbejde med, så vi tænkte, at vi bare ville beholde dem i det miljø, hvor de er glade, og de er glade på overfladen af en pattedyrcelle, " sagde Maynard.
TCR'er skaber naturligvis løse bånd til deres mål, men forfatterne ønskede, at deres skulle binde sig og ikke give slip. For at styrke disse forbindelser, forfatterne muterede tilfældigt DNA'et af TCR-komponenten, der detekterer CMV-peptidet. De indsatte derefter mange versioner af det muterede DNA i hamsterceller, som derefter fremstillede omkring en million forskellige typer TCR, Sagde Maynard.
Forskerne målte derefter, hvilken muteret version der etablerede den stærkeste binding ved at udsætte de utallige TCR-variationer udtrykt på overfladen af hamstercellerne for CMV-peptidet.
"Vi fandt en, der var vores favorit, " sagde Maynard. "Vi forbedrede bindingsaffiniteten 50 gange."
Derefter var udfordringen at frigøre TCR'erne fra T -cellemembranen. For at opnå dette, forskerne redigerede yderligere DNA'et, så TCR'erne ville binde sig til det protein, der udgør stammen af "Y"-formede antistoffer. Og for at hjælpe disse proteiner med at holde deres form, de tilføjede en binding inde i TCR og forhindrede også sukker i at tilsætte. Alt i alt, disse ændringer syntes at gøre tricket, sagde Maynard.
Disse "antistoflignende" TCR'er kan bruges til at spore sygdomsprogression hos patienter eller til at evaluere, hvor godt udviklende vacciner virker. Disse TCR'er kan også genoprette noget af det tabte immunrespons hos immunkompromitterede patienter ved at instruere deres celler til at angribe CMV-infektioner, sagde Maynard.
En anden stor mulighed for dette nye molekyle er at behandle glioblastom. Selvom hjernetumorerne ikke producerer mange forskellige markører, de undertrykker immunsystemet, som hos CMV-inficerede patienter kan bringe virussen tilbage til livet i kræftcellerne, sagde Maynard.
"Vores protein kunne bruges til specifikt at målrette mod glioblastomceller, og det ville give en meget unik markør, " sagde Maynard. "Vi ville bruge dette til at overvåge eller dræbe nogle af de tumorceller."
 Varme artikler
Varme artikler
-
 Lysfølsomt øverste lag af plastikfilm fremkalder bevægelseSkematisk af filmen (til venstre):Filmen er for det meste sammensat af en ikke-fotoresponsiv polymer (200 - 400 nm tyk), og et fotoresponsivt polymerlag eksisterer kun ved overfladen (nogle nm tykt).
Lysfølsomt øverste lag af plastikfilm fremkalder bevægelseSkematisk af filmen (til venstre):Filmen er for det meste sammensat af en ikke-fotoresponsiv polymer (200 - 400 nm tyk), og et fotoresponsivt polymerlag eksisterer kun ved overfladen (nogle nm tykt). -
 Forskere udvikler nye metoder og smarte brøndboringsmaterialer til geotermisk boringSaleh og teamet udvikler nye smarte mistede cirkulationsmaterialer, der udvider sig inden for sprækkerne for at reducere ikke-boringstid og styrke brøndboringen i højtemperatur-boreoperationer. Kredit
Forskere udvikler nye metoder og smarte brøndboringsmaterialer til geotermisk boringSaleh og teamet udvikler nye smarte mistede cirkulationsmaterialer, der udvider sig inden for sprækkerne for at reducere ikke-boringstid og styrke brøndboringen i højtemperatur-boreoperationer. Kredit -
 Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m
Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m -
 Ny immunoassay-teknik måler ekstremt lave koncentrationer af små molekyler ved hjælp af enkelt-mo…Skematisk illustration af konkurrerende Simoa-assays ved anvendelse af analytmodificerede MBer (A) og analyt-mærket β-galactosidase som konkurrent (B). Kredit:(c) Journal of the American Chemical Soc
Ny immunoassay-teknik måler ekstremt lave koncentrationer af små molekyler ved hjælp af enkelt-mo…Skematisk illustration af konkurrerende Simoa-assays ved anvendelse af analytmodificerede MBer (A) og analyt-mærket β-galactosidase som konkurrent (B). Kredit:(c) Journal of the American Chemical Soc


