Internationale videnskabelige teams finder en potentiel fremgangsmåde mod parasitter
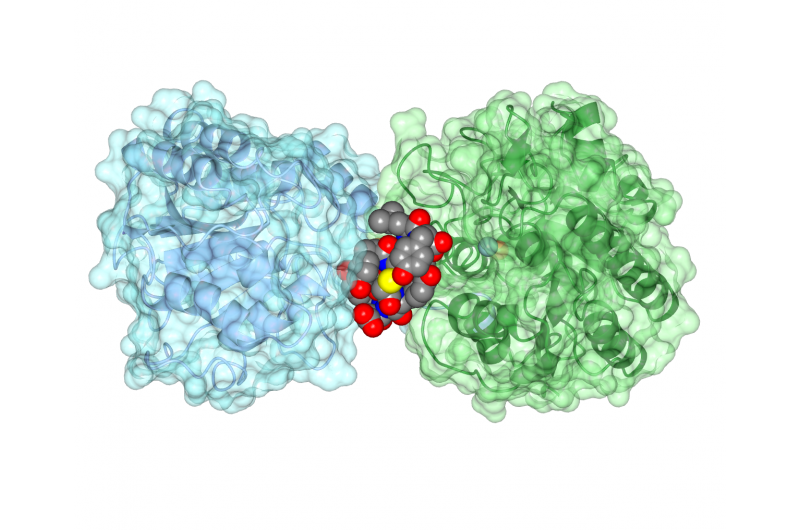
Det cykliske peptid ipglycermid binder til et iPGM -enzym, blokerer dens aktivitet. Kredit:Jim Inglese, NCATS
Forskergrupper fra National Institutes of Health og i udlandet har identificeret den første hæmmer af et enzym, man længe troede var et potentielt lægemiddelmål til bekæmpelse af sygdomsfremkaldende parasitter og bakterier. Holdene, ledet af NIH's National Center for Advancing Translational Sciences (NCATS) og University of Tokyo forskere, sorteret gennem mere end 1 billion små proteinfragmenter kaldet cykliske peptider for at afdække to, der kunne lukke enzymet ned. Fundet, rapporterede 3. april, 2017 i Naturkommunikation , kunne sætte scenen for den potentielle udvikling af nye typer antimikrobielle lægemidler.
NCATS 'ekspertise i en tidlig fase, præklinisk opdagelse af molekyler hjalp holdene med at finde potentielle lægemiddelkandidater, der kan få konsekvenser for millioner af mennesker verden over.
"Arbejdet er en glimrende demonstration af, hvordan NCATS leverer sin mission om at levere forbedringer i translationelle processer, "sagde Anton Simeonov, Ph.d., videnskabelig direktør, NCATS Division of Pre-Clinical Innovation. "Forskere har vist, at et terapeutisk mål, tidligere betragtet som utilbørlig af lægemiddelvirksomheder, er faktisk narkotika via et ikke-traditionelt terapeutisk middel. "
Målenzymet, cofaktor-uafhængig phosphoglyceratmutase (iPGM), findes i både parasitter og bakterier. Flere typer parasitiske rundorme har iPGM, herunder Brugia malayi og Onchocerca volvulus, som inficerer cirka 150 millioner mennesker, der hovedsageligt bor i tropiske områder. Disse parasitter kan forårsage ødelæggende infektionssygdomme, såsom flodblindhed. Enzymet findes også i bakterier, herunder Staphylococcus aureus, som kan forårsage den hospitalsbårne infektion MRSA (methicillinresistent Staphylococcus aureus), og Bacillus anthracis, som forårsager miltbrand.
"Flere infektiøse organismer er potentielt modtagelige for en iPGM -hæmmer, "sagde den medsvarende forfatter James Inglese, Ph.d., direktør, NCATS Assay Development and Screening Technology Laboratory. "Holdet kaldte inhibitorpeptidernes ipglycermider, ', der repræsenterer en stærk klasse af iPGM -hæmmere. I teorien, et sådant lægemiddel kan blive et bredspektret anti-parasitisk og antibakteriel behandling. "
Nuværende anti-parasitiske lægemidler, såsom ivermectin, hovedsageligt arbejde på de tidlige larvestadier af ormen. En sådan behandling skal gives årligt eller halvårligt i op til et årti. Årevis, forskere har forsøgt at finde et mere effektivt lægemiddel, der også virkede mod den voksne orm og de senere stadier af infektion. Tidligere undersøgelser af Ingleses samarbejdspartnere ved New England Biolabs i Ipswich, Massachusetts, viste, at iPGM er et af mange essentielle enzymer, som rundormen har brug for for at overleve. Det er en del af en fælles biologisk proces kaldet glykolyse, som hjælper med at skabe energi til celler. Mens den samme vigtige proces forekommer i menneskelige celler, den er afhængig af en anden form for enzymet. Som resultat, et lægemiddel, der er målrettet mod iPGM og dræber rundormen, ville sandsynligvis efterlade den menneskelige modstykke alene. Et sådant lægemiddel kan virke på alle stadier af ormen, og infektionen kan muligvis behandles akut, ligner et antibiotikum. Imidlertid, deres tidligere forsøg på at finde en forbindelse til at blokere enzymet har mislykkedes.
Enzymer er proteiner, der sætter kemiske reaktioner i gang. De fleste enzymer har lommeformede "aktive steder", som et molekyle passer ind i, og som enzymet virker på. Små molekyllægemidler kan passe på aktive steder og forhindre, eller hæmmer, enzymet fra at udføre sit biologiske job. Men iPGM og andre lignende enzymer er forskellige. iPGM har en kortvarig, midlertidigt aktivt websted, gør det praktisk talt umuligt at finde et lægemiddel med et lille molekyle, der kan blokere enzymet.
På grund af enzymets usædvanlige design, det NCATS-ledede team søgte en anden type medicin end de typiske småmolekylære lægemidler. Inglese samarbejdede med den tilsvarende forfatter Hiroaki Suga, Ph.d., ved universitetet i Tokyo, at bygge en biblioteksblanding af mere end 1 billion små peptider. Holdet gik et skridt videre, tilsætning af en aminosyre til peptiderne for at skabe ringformede cykliske peptider, som forskerne antog ville have den nødvendige form og struktur til at fæstne til enzymoverfladen og deaktivere enzymet.
Forskerne sigtede gentagne gange gennem de cykliske peptider for at finde ud af, hvilket der ville klæbe mest til enzymet. De fandt to cykliske peptider, der begge bundet stramt til kun iPGM -enzymet og også lukkede dets aktivitet.
Holdet arbejdede efterfølgende med strukturbiologer ved University of Kansas, Lawrence, at bestemme strukturen af iPGM-cyklisk peptidarrangement, viser, hvordan peptidet forhindrede enzymet i at fungere korrekt. "Det cykliske peptid har en forbløffende stram og selektiv affinitet til iPGM, som et antistof, "Sagde engelsk.
Gruppens næste trin vil være at finde måder, hvorpå cykliske peptider kan komme ind i celler. "Hvis vi kan finde måder at putte cykliske peptider i celler, så ville dette åbne op for nye mål, som små molekylærlægemidler har svært ved at løse, "Inglese sagde." Ipglycermider repræsenterer et frugtbart, men ikke -dyrket landskab mellem små molekylemedicin og proteinbiologi. "
Sidste artikelKemikalier, der helbreder malaria, kan også dræbe ukrudt
Næste artikelRoterende molekyler skaber en lysere fremtid
 Varme artikler
Varme artikler
-
 En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat
En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat -
 Bygger molekyler som Tinkertoys? Et banebrydende studie kan bane vejenEt team af kemikere ved University of Chicago annoncerede en ny teknik, der gør det muligt for forskere let at skære nitrogenatomer fra molekyler-hvilket kan gøre processen med at finde nye molekyler
Bygger molekyler som Tinkertoys? Et banebrydende studie kan bane vejenEt team af kemikere ved University of Chicago annoncerede en ny teknik, der gør det muligt for forskere let at skære nitrogenatomer fra molekyler-hvilket kan gøre processen med at finde nye molekyler -
 Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis
Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis -
 Forskere opdager unikke egenskaber ved kritisk metan-producerende enzymKugle og pind model af metan. Kredit:Ben Mills/Public Domain En uventet opdagelse har givet forskerne en større forståelse af et vigtigt metanproducerende enzym. Et team af forskere ved Carl R. W
Forskere opdager unikke egenskaber ved kritisk metan-producerende enzymKugle og pind model af metan. Kredit:Ben Mills/Public Domain En uventet opdagelse har givet forskerne en større forståelse af et vigtigt metanproducerende enzym. Et team af forskere ved Carl R. W
- Big Tech -tilbageslag går i gang med antitrustbevægelser
- AIs første popalbum indleder en ny musikalsk æra
- Sikring af anstændige levestandarder for alle, samtidig med at det globale energiforbrug reduceres
- Undersøgelse:Alle større kinesiske byer, der er i stand til at generere solenergi billigere end el…
- En simpel mekanisme kunne have været afgørende for livets udvikling
- Pendulets historie


