Med mere lys, kemien tager fart

Nogle kemiske reaktioner kan fremskyndes ved at øge intensiteten af belysning - dette er blevet demonstreret af forskere fra Institut for Fysisk Kemi ved det polske videnskabsakademi i Warszawa. Kredit:IPC PAS, Grzegorz Krzyzewski
Lys igangsætter mange kemiske reaktioner. Eksperimenter ved aser-centret for Institut for Fysisk Kemi ved det polske videnskabsakademi og Warszawas Universitets Fysiske fakultet har, for første gang, demonstreret, at ved at øge belysningsintensiteten, nogle reaktioner kan fremskyndes betydeligt. Her, forskere opnåede reaktionsacceleration ved hjælp af par af ultrakorte laserimpulser.
For grundigt at undersøge karakteren af de involverede processer, forskerne brugte ultrakorte på hinanden følgende par laserimpulser. En høj stigning i reaktionshastigheden mellem molekylerne blev observeret. Warszawa-videnskabsmændene har rapporteret deres resultater i Fysisk kemi Kemisk fysik .
"Vores eksperimenter giver grundlæggende viden om de fysiske processer, der er vigtige for forløbet af vigtige lys-inducerede reaktioner. Denne viden kan potentielt bruges i mange applikationer, især når man har at gøre med lyskilder med høj intensitet. Disse omfatter, blandt andre, forskellige mikroskopiske billeddannelsesteknikker, ultrahurtig spektroskopi og fotovoltaik, især hvis der anvendes lysfokuserende enheder såsom solfangere, " siger Dr. Gonzalo Angulo (IPC PAS).
I lys-inducerede reaktioner, en foton med den passende energi exciterer et farvestofmolekyle. Når der er et quencher-molekyle nær det exciterede molekyle, en interaktion finder sted. Der kan være en overførsel af energi, en elektron eller en proton, mellem de to reaktanter. Reaktioner af denne type er almindelige i naturen. Et godt eksempel er elektronoverførsel i fotosyntese, som spiller en nøglerolle i dannelsen af Jordens økosystem.
En faktor, der kan påvirke reaktionshastigheden, er intensiteten af det lys, der initierer dem. For at studere arten af disse processer, kemikerne brugte laserimpulser, der varede femtosekunder, i stedet for den traditionelle kontinuerlige lysstrøm. Impulsernes energi blev justeret, så farvestofmolekylerne bevægede sig ind i den exciterede energitilstand. Impulserne blev grupperet i par. Intervallet mellem pulser i et par var adskillige dusin picosekunder (billiontedele af et sekund) og var tilpasset typen af reagerende molekyler og miljøet i opløsningen.
"Teorien og eksperimenterne krævede omsorg og opmærksomhed, men selve den fysiske idé er ret enkel, her, " bemærker Jadwiga Milkiewicz, en ph.d. studerende på IPC PAS, og forklarer:"For at reaktionen kan opstå, der skal være et quencher-molekyle i nærheden af det lysexciterede farvestofmolekyle. Så hvis vi har et par molekyler, der allerede har reageret med hinanden, det betyder, at de var tæt nok på hinanden. Hvis, efter reaktionen, begge molekyler har formået at vende tilbage til deres grundtilstand, absorptionen af en ny foton af farvestoffet har potentialet til at igangsætte en anden reaktion, før molekylerne bevæger sig væk fra hinanden i rummet."
Reaktionsforløbet i opløsninger afhænger af mange faktorer såsom temperatur, tryk, viskositet eller tilstedeværelsen af et elektrisk eller magnetisk felt. Forskningen ved IPC PAS har bevist, at disse faktorer også påvirker accelerationen af den kemiske reaktion, der opstår med en øget belysningsintensitet. Under nogle forhold, accelerationen af reaktionen var umærkelig; under optimale forhold, reaktionshastigheden steg med 25 til 30 procent.
"I vores hidtil eksperimenter, vi har koncentreret os om lysinducerede elektronoverførselsreaktioner - dvs. dem, der ændrer molekylernes elektriske ladning. Imidlertid, vi kan ikke se nogen grund til, at den mekanisme, vi har observeret, ikke kunne fungere i andre variationer af disse reaktioner. Så i den nærmeste fremtid, vi vil forsøge at bekræfte dets effektivitet i energioverførselsreaktioner eller i reaktioner, der også involverer protonoverførsel, " siger Dr. Angulo.
 Varme artikler
Varme artikler
-
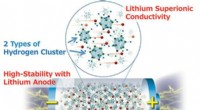 Ny forskning viser, at den højeste energitæthed af alle solid-state-batterier nu er muligHøj-energi-densitet hel-solid-state lithium metalbatteri, der anvender komplekse hydrider. Kredit:Sangryun Kim og Shin-ichi Orimo Forskere fra Tohoku University og High Energy Accelerator Research
Ny forskning viser, at den højeste energitæthed af alle solid-state-batterier nu er muligHøj-energi-densitet hel-solid-state lithium metalbatteri, der anvender komplekse hydrider. Kredit:Sangryun Kim og Shin-ichi Orimo Forskere fra Tohoku University og High Energy Accelerator Research -
 Atomindstilling på kobolt muliggør en ottedobbelt stigning i hydrogenperoxidproduktionen3D-billede af enkelte koboltatomer på nitrogendoperet grafen. Det var afgørende for denne undersøgelse at kontrollere koordineringsmiljøet for et enkelt koboltatom, da denne koordineringsstruktur dire
Atomindstilling på kobolt muliggør en ottedobbelt stigning i hydrogenperoxidproduktionen3D-billede af enkelte koboltatomer på nitrogendoperet grafen. Det var afgørende for denne undersøgelse at kontrollere koordineringsmiljøet for et enkelt koboltatom, da denne koordineringsstruktur dire -
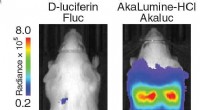 I levende farver:at se celler udefra kroppen med syntetisk bioluminescensBioluminescensbilleder af mus intravenøst injiceret med 103 HeLa-celler, der udtrykker Fluc (venstre) eller Akaluc (højre). Substratadministration blev udført intraperitonealt. Billeder blev erhverv
I levende farver:at se celler udefra kroppen med syntetisk bioluminescensBioluminescensbilleder af mus intravenøst injiceret med 103 HeLa-celler, der udtrykker Fluc (venstre) eller Akaluc (højre). Substratadministration blev udført intraperitonealt. Billeder blev erhverv -
 Sådan beregnes et rørplannummerDen oprindelige designproces til beregning af et passende rørskema nummer, der først blev udformet i 1939, har siden udviklet sig til at vælge en passende rørplan for en applikation. Den oprindelige h
Sådan beregnes et rørplannummerDen oprindelige designproces til beregning af et passende rørskema nummer, der først blev udformet i 1939, har siden udviklet sig til at vælge en passende rørplan for en applikation. Den oprindelige h
- Floders evolution udfolder sig med en frisk blanding af datingteknikker
- Hvad er fordelene ved ribosomer?
- Journalister smækker i afventende lov om digital sikkerhed i Bangladesh
- Forskere afslører en anomali i den elektromagnetiske dualitet af Maxwell Theory
- Et kontrolsystem til at forbedre effektiviteten af bølgeenergiomformere
- Samforbrænding af træ og olieskifer reducerer kulstofemissioner


