Succesfuld syntese af en ny insulinanalog
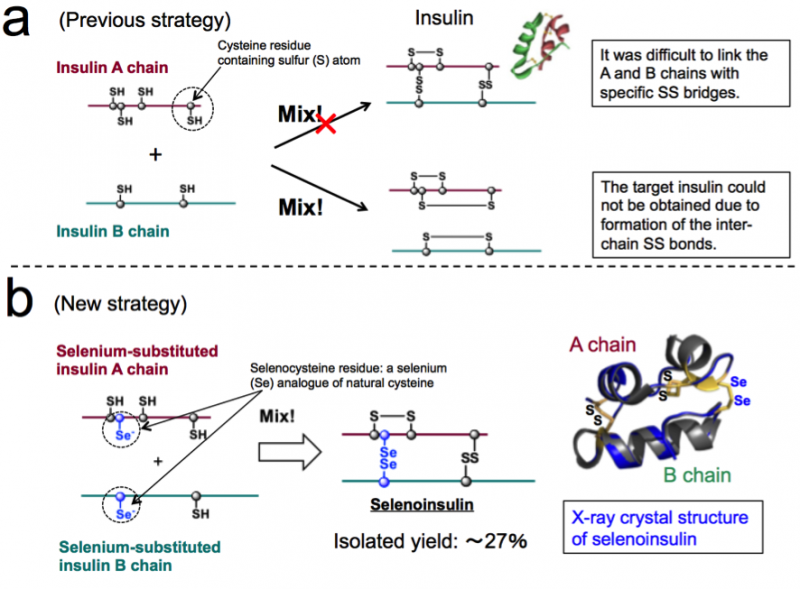
Figur 1. Kemisk syntese af insulin. (a) Tidligere strategi baseret på koblingen mellem native insulin A- og B-kæder. (b) Ny strategi, der udnytter den unikke karakter af selenocystein og røntgenkrystalstruktur af selenoinsulin. (Disse tal er citeret fra den originale artikel med ændringer.). Kredit:Osaka University
En gruppe forskere har udviklet syntetiske insulinanaloger selenoinsulin (Se-Ins) gennem udskiftning af interchain-disulfid i bovin pancreasinsulin (BPIns) med en diselenidbro.
Denne gruppe viste, at Se-Ins havde en næsten identisk struktur og bioaktivitet sammenlignelig med BPins, og at det havde øget modstand mod IDE-nedbrydning. Dette lover for anvendelse af Se-Ins til et langtidsholdbart insulinpræparat i diabetesbehandling.
Efter at have cirkuleret i blodbanen, insulin nedbrydes af et insulinnedbrydende enzym (IDE) i nyrerne og udskilles i urinen. Denne gruppe mente, at produktionen af insulin med høj resistens over for nedbrydning af IDE ville føre til udviklingen af en ny type langtidsholdbare insulinpræparater, som kunne cirkulere i kroppen i lang tid.
Insulin består af to polypeptidkæder:A-kæde og B-kæde, forbundet med en disulfidbinding (Se-Se-binding), så det er svært kun at tage insulin fra disse kæder på grund af Se−Se-bindinger. Dermed, denne gruppe mente, at hvis insulin A-kæder og B-kæder indeholdende selen (Se) i stedet for svovl (S), blev brugt, diselenidbindingen (Se−Se-binding) ville blive dannet hurtigt, og derefter kunne kædesamlingsreaktionen udføres effektivt, da Se er mere reaktivt end S.
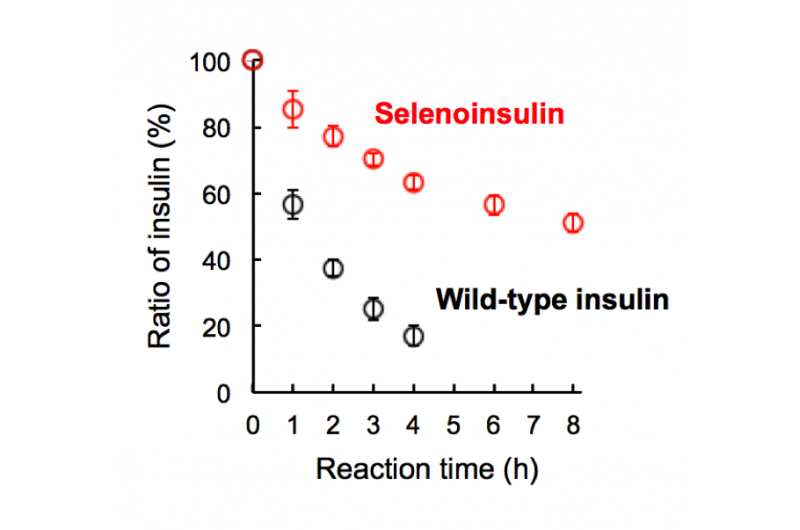
Figur 2. Nedbrydning af selenoinsulin (rød) og vildtype-insulin (sort) af insulinnedbrydende enzym (IDE). (Denne figur blev citeret fra den originale artikel med små ændringer.). Kredit:Osaka University
Ud over, Se-Se-obligationer er mere stabile end S-S-obligationer, så denne gruppe forventede, at Se-Se-bindinger ville give ekstra strukturel robusthed på insulinfolden, hvilket resulterer i den forbedrede modstand mod IDE-nedbrydning på grund af dens iboende stabilitet. Baseret på dette koncept, denne gruppe lykkedes med syntesen af Se-holdige insulin A- og B-kæder, samt opnåelse af Se-Ins ved isolationsudbyttet på op til 27% ved at reagere peptidkæder under optimale forhold.
Denne gruppe viste, at Se-Ins havde en næsten identisk struktur med BPI'er, tyder på, at Se-Ins har en bioaktivitet, der kan sammenlignes med BPI'er. Eksperimenter med nedbrydning af BPI'er og Se-In'er ved brug af IDE viste, at nedbrydningshastigheden af Se-In'er var meget langsommere end BPI'er. Fra dette, det menes, at Se-Ins har en langtidsholdbar karakter og kan være en ny klasse af langtidsvirkende insulinanaloger til diabetesbehandling.
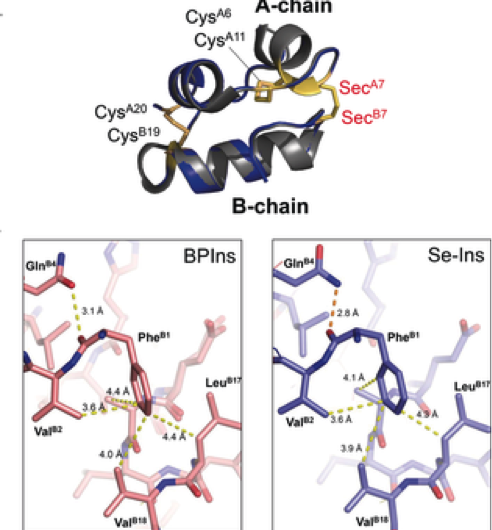
Figur 3. Fremstilling af selenoinsulin som en langvarig insulinanalog. Kredit:Osaka University
Sidste artikelDivalent guldkompleks isoleret for første gang i ren form
Næste artikelSød! Sukkerbelagt probe giver bedre syretest
 Varme artikler
Varme artikler
-
 Kvægs embryo regenererer fuldstændigt placenta-dannende cellerEt tidligt bovint embryo, der regenererer sine TE -celler, som senere vil udgøre en stor del af moderkagen. (Venstre:intakt, Midt:efter fjernelse af TE, Til højre:regenereret). Kredit:Kohri N. et al.,
Kvægs embryo regenererer fuldstændigt placenta-dannende cellerEt tidligt bovint embryo, der regenererer sine TE -celler, som senere vil udgøre en stor del af moderkagen. (Venstre:intakt, Midt:efter fjernelse af TE, Til højre:regenereret). Kredit:Kohri N. et al., -
 3D-elektronmikroskopi afdækker de komplekse tarme i afsaltningsmembranerIntern struktur af den tynde polyamidfilm. Kredit:Enrique Gomez, Penn State Omhyggelig prøveforberedelse, elektron tomografi og kvantitativ analyse af 3D-modeller giver enestående indsigt i den in
3D-elektronmikroskopi afdækker de komplekse tarme i afsaltningsmembranerIntern struktur af den tynde polyamidfilm. Kredit:Enrique Gomez, Penn State Omhyggelig prøveforberedelse, elektron tomografi og kvantitativ analyse af 3D-modeller giver enestående indsigt i den in -
 Ved hjælp af DNA -tråde til at designe nye polymermaterialerForskere fra McGill University har kemisk præget polymerpartikler med DNA-strenge - en teknik, der kan føre til nye materialer til anvendelser lige fra biomedicin til det lovende område blød robottekn
Ved hjælp af DNA -tråde til at designe nye polymermaterialerForskere fra McGill University har kemisk præget polymerpartikler med DNA-strenge - en teknik, der kan føre til nye materialer til anvendelser lige fra biomedicin til det lovende område blød robottekn -
 Ny forskning optimerer både elasticitet og stivhed i det samme materiale uden de sædvanlige afvejn…Muslinger og andre indbyggere i den stenede tidevandszone har udviklet sofistikerede metoder til at klæbe til overflader på trods af bølger og vind Kredit: Kollbe Ahn I materialernes verden, stivh
Ny forskning optimerer både elasticitet og stivhed i det samme materiale uden de sædvanlige afvejn…Muslinger og andre indbyggere i den stenede tidevandszone har udviklet sofistikerede metoder til at klæbe til overflader på trods af bølger og vind Kredit: Kollbe Ahn I materialernes verden, stivh
- Efter Kepler -supernovaeksplosionen, ingen overlevende blev efterladt
- Renault-Nissan vil bruge Android-systemet i sine dashboards
- Fordelene ved at bruge en uafhængig gruppe T-Test
- Social afstand, bæredygtige byer og opbygning af folkesundhedskapacitet
- Nanopartikler kan rejse fra lunger til blod, muligvis forklare risici til hjertet
- Sådan laver du en kano til et skoleprojekt


