Forskere opdager en af naturens mindste kontakter

Forskning udført af et hold, herunder kemidoktorand Chuhan Zong og A. James Link, lektor i kemi- og biologisk teknik, har opdaget lassoformede bakteriemolekyler, der er i stand til at ændre deres form, når de udsættes for varme. Kredit:Frank Wojciechowski
Hvis fremkomsten af computere lancerede informationsalderen, evnen til at konstruere små maskiner ud fra molekyler kunne definere de kommende årtier.
Som et vidnesbyrd om nanoteknologiens hurtige fremskridt, Nobelprisen i kemi i 2016 blev tildelt videnskabsmænd, der byggede verdens første syntetiske molekylære maskiner ved at sammenkoble enkelte molekyler i enheder, der er i stand til mekanisk bevægelse.
Nu, en opdagelse af Princeton University-forskere, rapporteret 2. august i Journal of the American Chemical Society , viser, at mennesker ikke har monopol på at bygge verdens mindste maskiner. Princeton-forskerne fandt et lassoformet bakteriemolekyle, der er i stand til at ændre dets konfiguration, når det udsættes for varme, en formændrende evne svarende til den, der bruges til at betjene visse syntetiske molekylære maskiner. Lasso er en type molekylær kæde kendt som et peptid.
"Opdagelsen af dette lasso peptid, som vi kaldte benenodin-1, demonstrerer, at vi kan se til biologi såvel som ingeniørarbejde for kildemateriale i udviklingen af molekylære enheder, " sagde A. James Link, en lektor i kemisk og biologisk ingeniørvidenskab ved Princeton, som var den øverste forfatter på papiret.
Mens ansøgningerne stadig for det meste er spekulative, de potentielle anvendelser for molekylære maskiner er enorme, spænder over alt fra mikrorobotter, der afgiver lægemidler i den menneskelige krop til nye typer materialer, der i realtid tilpasser sig miljøændringer såsom udsving i varme, lys eller fugt.
De første store fremskridt inden for bygning af molekylære maskiner kom i 1980'erne, da kemiker Jean-Pierre Sauvage var i stand til at bygge mekanisk forbundne molekyler ved at forbinde to molekylære ringe. Dette stod i kontrast til den klassiske teknik med at forbinde molekyler gennem kovalente bindinger, en kemisk binding, hvor molekyler fæstner ved at dele elektroner.
I begyndelsen af 1990'erne, en anden videnskabsmand, Fraser Stoddart, skabt en ny struktur, kaldet en rotaxan, ved at føre en molekylær stang gennem en ring af molekyler og sikre den på plads. Ringen kunne bevæge sig op og ned af stangen, men ville ikke falde af på grund af stoppere Stoddart tilføjede til hver ende af stangen. Siden deres fremkomst, rotaxaner er blevet brugt til at skabe et løft i nanoskala, en kunstig muskel og endda en lillebitte computer. Sauvage og Stoddart delte 2016 Nobelprisen i kemi med en anden videnskabsmand, Bernard Feringa, der byggede molekylære motorer, inklusive en, der er i stand til at dreje en lille glasstang, der var 10, 000 større end selve maskinen.
Mens de molekylære maskiner bygget af Sauvage, Stoddart og Feringa blev syntetiseret i laboratorier, Link og hans Princeton-kolleger har kigget til naturen for at få inspiration til nanoteknologi.
Links team har udviklet metoder til at søge i organismers DNA-sekvenser for beviser for, at de kan producere peptider. Ligesom deres større fætre, proteiner, peptider er kæder af koblede aminosyrer.
Links team har udviklet metoder til at søge organismers DNA for beviser for, at de kan producere peptider; nogle peptider har usædvanlige strukturer, der gør dem af interesse for videnskabsmænd, der udforsker, hvordan man bygger molekylære switche og maskiner. Kredit:Frank Wojciechowski
I særdeleshed, Link har fokuseret på at opdage lasso peptider, en klasse af molekyler kendetegnet ved en slip-knude-lignende form, hvor en lang "hale" sektion af molekylet stikker gennem en "ring" sektion. Navnet på denne klasse af peptider stammer fra ligheden i deres struktur og den af lariat-knuder, der bruges i cowboy-lassoer. Deres struktur gør lasso peptider meget stabile, en vigtig biologisk egenskab. Holdes sammen gennem mekaniske bindinger, lasso peptiderne ligner også Stoddarts ring-og-stang rotaxane strukturer, og er således klassificeret som rotaxaner.
Nogle lassopeptider har antimikrobielle egenskaber og kan repræsentere en ny type antibiotika, et område Links laboratorium udforsker. Peptidernes rotaxanstruktur gør dem også til mulige kandidater til at bygge molekylære maskiner.
Princeton-holdet opdagede lasso-peptidet benenodin-1, mens de udforskede DNA'et fra Asticcacaulis benevestitus, en jordproteobakterie fra Ruslands Uralbjerge. Når de udsættes for varme, mange naturligt forekommende lassopeptider bliver utrådede, med haledelen af molekylet glidende ud af ringen. Da Princeton-forskerne udsatte benenodin-1 for varme, de blev overraskede over at opdage, at molekylet ændrede form, men fastholdt sin slip-knot bekræftelse.
"Denne evne til at ændre form uden at løsne tråden er spændende, " sagde Link. "Begge konformationer opretholder rotaxanstrukturen, hvilket gør det til det første eksempel på en omskiftelig, mekanisk sammenkoblet molekyle fundet i naturen."
"Det rejser spørgsmål om, hvorvidt der er en evolutionær forklaring på denne adfærd, og om andre sådanne skiftende molekyler kan eksistere i naturen, " han sagde.
Link og hans kolleger fandt også andre spændende ændringer i benenodin-1s kemiske adfærd, der blev udløst af varme. Før varmepåvirkning, lassopeptidet kunne hakkes op af et enzym kaldet benenodin-1 isopeptidase. Men efter opvarmning ændrede lassopeptidet til dets nye konfiguration, det var ikke længere påvirket af enzymet.
Link sagde, at denne forskel i, hvordan enzymet fungerer under forskellige temperaturer, kan omsættes til ændringer i biologisk funktion, et fænomen, der kan spille en rolle i, hvordan klimaændringer påvirker mikrobielle samfund i jorden.
Princeton-teamet planlægger at undersøge, om switching-egenskaben for benenodin-1 kan bruges i praktiske applikationer, såsom at binde metalforurenende stoffer for at hjælpe med miljøoprydning.
Peptidet kan også give en naturlig kilde til byggestenene i nanostrukturer, hvor to molekylære ringe er fysisk sløjfet sammen. Forskere undersøger, om disse nanostrukturer kan bruges til at bygge molekylære elektroniske enheder og sensorer. For eksempel, de kan bruges som termiske sensorer, der kan indikere, når en pakke med termisk følsomme materialer såsom medicin er blevet udsat for varme.
"Opdagelsen af denne naturlige omskiftningsegenskab i et lassopeptid åbner mange nye muligheder for forskning, fra at udforske udviklingen af peptider og enzymer, til brugen af naturlige produkter i nanoteknologi, " sagde Link.
 Varme artikler
Varme artikler
-
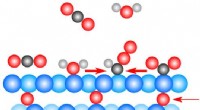 Forskere finder en overraskelse lige under overfladen i kuldioxideksperimentI denne illustration på atomare skala, spormængder af ilt (rød) lige under en kobber (blå) overflade, spiller en nøglerolle i at drive en katalytisk reaktion, hvor kuldioxid (sorte og røde molekyler)
Forskere finder en overraskelse lige under overfladen i kuldioxideksperimentI denne illustration på atomare skala, spormængder af ilt (rød) lige under en kobber (blå) overflade, spiller en nøglerolle i at drive en katalytisk reaktion, hvor kuldioxid (sorte og røde molekyler) -
 Nye nanoporøse metalskum bruger sollys til at rense vandKredit:University of Bath En forsker fra University of Bath går forrest i at skabe et nyt, mere effektiv måde for vandindustrien til sikkert at fjerne mikropollutanter fra vand uden at øge deres C
Nye nanoporøse metalskum bruger sollys til at rense vandKredit:University of Bath En forsker fra University of Bath går forrest i at skabe et nyt, mere effektiv måde for vandindustrien til sikkert at fjerne mikropollutanter fra vand uden at øge deres C -
 Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U
Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U -
 Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om
Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om
- Forskere skaber et unikt instrument til at undersøge det mest ekstreme stof på Jorden
- Fra valgforstyrrelser til klimakaos, at kaste terningerne hjælper os med at værdsætte oddsene
- AI er en beskidt lille hemmelighed:Den drives af mennesker
- Amerikanske gear til stigende dødstal i vestkystbrande
- Biokemikere opdager, hvordan reaktive iltarter påvirker cisplatinresistens i æggestokkræftceller
- Facebook lukker London, Kontorer i Singapore efter tilfælde af coronavirus


