Ny protonstarter til optogenetik
Kredit:MIPT
Forskere har undersøgt et protein, der finder anvendelse i optogenetik og kan bruges til at kontrollere muskler og neuronale celler. Papiret om det lysfølsomme NsXeRprotein fra xenorhodopsin-klassen blev offentliggjort i Videnskab fremskridt af det internationale team af forskere fra MIPT, Forschungszentrum Jülich, og Institut de Biologie Structurale.
Optogenetik er en ny teknik, der bruger lys til at styre neuroner eller muskelceller i levende væv. Det har fundet bred anvendelse i undersøgelser af nervesystemet. Optogenetiske manipulationer er så præcise, at de gør det muligt at kontrollere individuelle neuroner ved at slå visse informationsoverførselsveje til eller fra. Lignende metoder bruges også til delvist at vende syn eller høretab samt til at kontrollere muskelsammentrækninger.
Optogenetics hovedværktøjer er lysfølsomme proteiner, der forsætligt indsættes i bestemte celler. Efter indsættelsen, proteinet bliver knyttet til celleoverfladen og bevæger ioner hen over membranen ved udsættelse for lys. Dermed, i en modificeret neuroncelle, en korrekt valgt lysimpuls kan aktivere et neuralt signal eller, tværtimod, undertrykke alle signaler, afhængigt af hvilket protein der bruges. Ved at aktivere signaler fra individuelle neuroner, det er muligt at efterligne funktionen af visse hjerneområder - en teknik, der modulerer opførsel af den undersøgte organisme. Hvis sådanne proteiner indsættes i muskelceller, et eksternt signal kan spænde eller slappe af.
Forfatterne til papiret, som blev offentliggjort i Videnskab fremskridt , beskrev et nyt optogenetisk værktøj - et protein kaldet NsXeR, som tilhører klassen xenorhodopsins . Når det udsættes for lys, det kan aktivere individuelle neuroner, får dem til at sende faste signaler til nervesystemet. Bortset fra anvendelser inden for forskning i nervesystemet, xenorhodopsins kan også overtage muskelcellekontrol. For at aktivere disse celler, det foretrækkes, at calciumiontransport blokeres, fordi ændringer i ionkoncentrationen kan påvirke dem. Ved brug af proteiner, der transporterer forskellige positive ioner (såsom calcium) ikke-selektivt, uønskede bivirkninger vil sandsynligvis forekomme.
Proteinet hjælper med at omgå ukontrolleret calciumtranslokation. Det er selektivt og pumper intet andet end protonerne ind i cellen. På grund af denne selektivitet, det har en betydelig fordel i forhold til sin chefkonkurrent channelrhodopsin, som bliver udbredt brugt i forskning, men ikke skelner mellem positivt ladede ioner. Hvad er mere, xenorhodopsinacts som en pålidelig pumpe, transporterer protoner både ind og ud af cellen uanset deres koncentration der henviser til, at channelrhodopsin kun tillader ioner at bevæge sig fra et område med højere koncentration til et område med lavere koncentration. I begge tilfælde reducerer en positiv ladningstilstrømning til en ophidset celle spændingen mellem dens indre og ydre membranoverflader. Sådan membrandepolarisering genererer en nerve- eller muskelimpuls. Evnen til at fremkalde en sådan impuls ved ikke at pumpe andet end protoner vil reducere mulige bivirkninger under forskning.
"Indtil videre har vi alle de nødvendige data om, hvordan proteinet fungerer. Dette vil blive grundlaget for vores videre forskning med det formål at optimere og tilpasse proteinparametrene til optogenetikkens behov, "siger Vitaly Shevchenko, hovedforfatter af papiret og en medarbejder ved MIPT Laboratory for Advanced Studies of Membrane Proteins.
 Varme artikler
Varme artikler
-
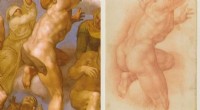 Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra
Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra -
 Selv maskiner har brug for deres greensKredit:CC0 Public Domain Et træ vokser sig stærkt efter år med at generere sin egen mad. Forestil dig nu, om produkter kunne styrkes med de samme levende materialer, der giver næringsstoffer til a
Selv maskiner har brug for deres greensKredit:CC0 Public Domain Et træ vokser sig stærkt efter år med at generere sin egen mad. Forestil dig nu, om produkter kunne styrkes med de samme levende materialer, der giver næringsstoffer til a -
 Ny mikroskopi virker ved ekstrem varme, kaster lys over legeringer til atomreaktorerAfsaneh Rabiei er her afbilledet med den enhed, hun udviklede, der kan fange scanning elektronmikroskopi (SEM) billeder i realtid ved temperaturer op til 1, 000 grader Celsius, mens der påføres spændi
Ny mikroskopi virker ved ekstrem varme, kaster lys over legeringer til atomreaktorerAfsaneh Rabiei er her afbilledet med den enhed, hun udviklede, der kan fange scanning elektronmikroskopi (SEM) billeder i realtid ved temperaturer op til 1, 000 grader Celsius, mens der påføres spændi -
 Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p
Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p


