Højopløsnings strukturel analyse af protein bag Huntingtons sygdom
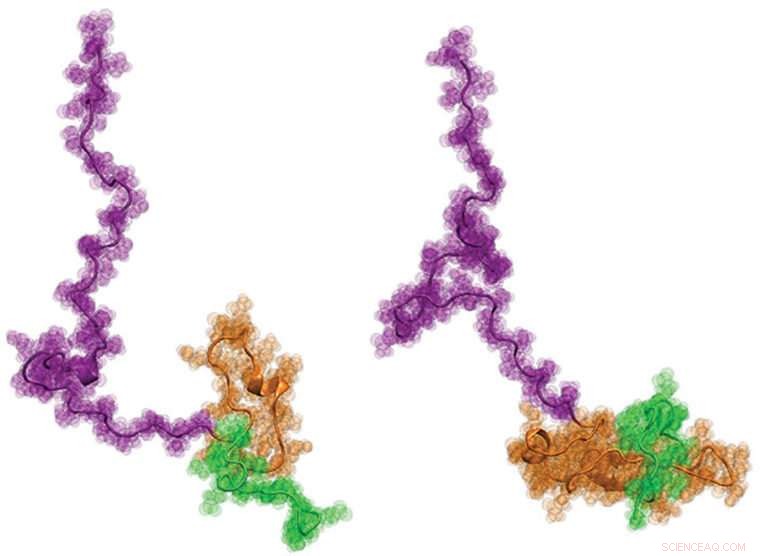
En international kohorte af forskere, herunder ingeniører fra Washington University i St. Louis, for nylig visualiseret Huntingtons protein for første gang. Det er håbet, at at vide mere om strukturen - som har en haletudse-lignende form - kunne hjælpe bedre med at informere udviklingen af nye terapier for sygdommen. Kredit:Washington University i St. Louis
Huntingtons sygdom er en progressiv, fatal neurodegenerativ lidelse, der er forårsaget af mutationer i et specifikt gen kaldet huntingtin (Htt). I de mere end 20 år siden Htt-genet blev identificeret, forskere har fokuseret på proteinet kodet af Htt-genet, kaldet Httex1. Dette protein ophobes i hjernen hos patienter med Huntingtons sygdom, og den fremherskende hypotese har været, at den gennemgår en dramatisk strukturel ændring, når en gentagen kanal af aminosyren glutamin muterer til en afvigende lang region kendt som den mutationelt udvidede polyglutamin (polyQ) kanal.
Nu, for første gang, teamet af Hilal A. Lashuel på Ècole Polytechnique Fèdèrale de Lausanne (EPFL) i Schweiz; Edward A. Lemke ved European Molecular Biology Laboratory (EMBL) i Tyskland; og Rohit V. Pappu ved Washington University i St. Louis har afsløret en detaljeret strukturel beskrivelse af Htt som en funktion af polyQ længde. Værket blev udgivet for nylig i Journal of the American Chemical Society .
En undersøgelse i tre trin
Det har været udfordrende at sikre strukturelle beskrivelser på atomniveau af Htt i fuld længde og sygdomsrelevante proteinfragmenter kaldet Httex1, fordi disse molekyler klæber til hinanden og hæmmer genereringen af rene proteinprøver til strukturelle undersøgelser. "Det er meget vanskeligt at opnå strukturel karakterisering af proteiner i en grød, " sagde Pappu, Edwin H. Murty professor i ingeniørvidenskab ved School of Engineering &Applied Science.
"Vores mål var at få indsigt i, hvordan forøgelse af længden af polyQ-halegentagelsen ændrer strukturen af dette protein på monomerniveau og under forhold, hvor vi er i stand til at afkoble dets foldning og selvsamling, " sagde Lashuel, professor i biovidenskab og direktør for laboratoriet for den kemiske biologi af neurodegeneration ved EPFL.
I første trin af undersøgelsen Lashuel og postdoc John B. Warner IV brugte nye kemiske strategier i deres laboratorium til at producere præcise, prøver af høj renhed af Htt til molekylær spektroskopi. Men disse kom kun i ultralave koncentrationer og krævede teknikker, der sonderer individuelle molekyler. Warner og Lashuel muliggjorde disse eksperimenter ved at generere prøver med stedspecifikke fluorescerende mærker.
Til projektets andet trin, Warner og Lashuel arbejdede sammen med Lemkes laboratorium på EMBL for at udføre enkelt-molekyle Förster (eller fluorescens) resonansenergioverførsel (smFRET), som er en teknik, der kan måle afstande mellem 1-10 nanometer inden for individuelle molekyler - i dette tilfælde, inden for individuelle Htt-proteiner. Denne del af undersøgelsen gav den første kvantitative vurdering af, hvordan de inter-atomare afstande i Httex1 varierer med ekspansionsmutationerne.
Endelig, forskerne arbejdede med Pappus laboratorium ved Washington University, hvor det udviklede nye computermodelleringstilgange til at producere fysisk nøjagtige, strukturelle modeller på atomniveau af Httex1, der bedst passer til alle enkeltmolekyledata fra de to foregående trin. Resultaterne var overraskende:Den overordnede struktur af Httex1 ligner en haletudse.
Haletudseeffekten
"Arkitektonisk, Httex1 er haletudseformet, med et kugleformet polyQ hoved og en floppy hale, " sagde Pappu. "Når polyQ-længden bliver længere, haletudsens hoved bliver større i overfladen. Dette øgede overfladeareal af hovedet ser ud til at skabe interaktioner, som ellers ikke burde være til stede i celler."
Opdagelsen udfordrer de mangeårige ideer om Httex1-akkumulering i Huntingtons sygdom. "Hvis den fremherskende hypotese var sand, " sagde Pappu, "så ville haletudsen være blevet til en 'frø', når polyQ-længden stiger over tærskelængden, men det ser ikke ud til at være tilfældet. De nye resultater fokuserer i stedet vores opmærksomhed på de nye gain-of-function cellulære interaktioner, der drives af haletudsestrukturen med et større polyQ-hoved."
"Mens den fremherskende hypotese har favoriseret en model, hvor mutant huntingtin-induceret toksicitet hovedsageligt er drevet af dens tilbøjelighed til at fejlfolde og aggregere, vores resultater tyder på, at afvigende interaktioner på monomerniveau også kan bidrage til initiering og/eller progression af sygdommen, " sagde Lashuel.
"Dette fund giver os mulighed for at undersøge, hvilke regioner af dette protein er vigtige at målrette mod, og modulere dets toksicitet på en specifik måde, sagde Kiersten M. Ruff, en postdoc-stipendiat i Pappus laboratorium, der har designet computersimuleringerne og er den første forfatter på papiret.
Den næste udfordring for forskerne er at forstå, hvordan disse strukturelle ændringer på monomerniveauet af Httex1 omsættes til øget aggregering og toksicitet, når længden af polyQ-halen krydser den patogene tærskel.
"Nøglen har været det centrale i samarbejdet mellem tre teams med komplementær og ikke-overlappende ekspertise, alle deler en forpligtelse til at fremme videnskaben, " sagde Lashuel.
 Varme artikler
Varme artikler
-
 Sådan beregnes procentdissociationNår stærke syrer anbringes i vand, adskiller de sig fuldstændigt. Det vil sige, at al syre (HA) adskilles i protoner (H +) og deres ledsagende anioner (A¯). I modsætning hertil adskiller svage syre
Sådan beregnes procentdissociationNår stærke syrer anbringes i vand, adskiller de sig fuldstændigt. Det vil sige, at al syre (HA) adskilles i protoner (H +) og deres ledsagende anioner (A¯). I modsætning hertil adskiller svage syre -
 Ny bakterietestmetode til at forbedre sundhedsplejen, fødevaresikkerhed og meget mereKredit:Unsplash/CC0 Public Domain Påvisning af levedygtige bakterier er vigtigt for forskellige områder, fra fødevaresikkerhed til medicinsk diagnose. De eksisterende teknikker til at udføre antib
Ny bakterietestmetode til at forbedre sundhedsplejen, fødevaresikkerhed og meget mereKredit:Unsplash/CC0 Public Domain Påvisning af levedygtige bakterier er vigtigt for forskellige områder, fra fødevaresikkerhed til medicinsk diagnose. De eksisterende teknikker til at udføre antib -
 Naturlige regnbuefarver fremstilles mikrobieltSystemets metaboliske teknik blev anvendt til at konstruere og optimere de metaboliske veje, og membranteknik blev anvendt til at øge produktionen af målfarvestofferne, succesfuldt at producere de s
Naturlige regnbuefarver fremstilles mikrobieltSystemets metaboliske teknik blev anvendt til at konstruere og optimere de metaboliske veje, og membranteknik blev anvendt til at øge produktionen af målfarvestofferne, succesfuldt at producere de s -
 Forskere fremmer søgning efter erindringers molekylære rødderEn model af CaMKII-proteinet viser flere domæner, der tillader det at binde actinfilamenter i neuronernes dendritter til bundter, giver dendritterne deres form. Forskere ved Rice University, Universit
Forskere fremmer søgning efter erindringers molekylære rødderEn model af CaMKII-proteinet viser flere domæner, der tillader det at binde actinfilamenter i neuronernes dendritter til bundter, giver dendritterne deres form. Forskere ved Rice University, Universit
- Stormjæger i position
- Nyt solinduceret klorofylfluorescensprodukt har til formål at forbedre forskningen i CO2-neutralite…
- Forskel mellem naturlig udvælgelse og nedstigning med modifikation
- Teoretikere foreslår ny klasse af topologiske metaller med eksotiske elektroniske egenskaber
- Ny forskning identificerer to typer tørke i hele Kina, og hvordan de udvikler sig
- COVID-19-pandemien bør være et wake-up call for vandsikkerhed


