Forskere fremmer søgning efter erindringers molekylære rødder
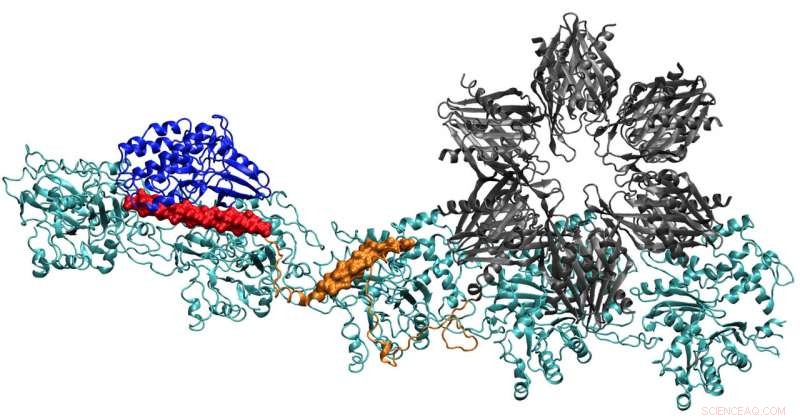
En model af CaMKII-proteinet viser flere domæner, der tillader det at binde actinfilamenter i neuronernes dendritter til bundter, giver dendritterne deres form. Forskere ved Rice University, University of Houston og University of Texas Health Science Center i Houston mener, at komplekset er nøglen til dannelsen af langtidshukommelse. Kredit:Wolynes Research Lab/Rice University
En ny brik i et vanskeligt puslespil – hukommelsens natur – faldt på plads i denne uge med et hint om, hvordan hjerneceller ændrer struktur, når de lærer noget.
Interaktioner mellem tre bevægelige dele - et bindende protein, et strukturelt protein og calcium - er en del af den proces, hvorved elektriske signaler trænger ind i neurale celler og omformer de molekylære strukturer, der menes at muliggøre kognition og lagring af minder.
Kolleger fra Rice University, University of Houston (UH) og University of Texas Health Science Center i Houston (UTHealth) kombinerede teorier, simuleringer og eksperimenter for at bestemme, hvordan et centralt bindende protein-calcium-calmodulin-afhængig kinase II (CaMKII)-binder og afbinder fra cytoskelettet af en neuron.
Holdets rapport i Proceedings of the National Academy of Sciences giver de første klare detaljer om, hvordan bindingsstederne af CaMKII virker for at tilpasse actinfilamenter - det strukturelle protein - til lange, stive bundter. Bundterne tjener som støtteskeletter af dendritiske rygsøjler, spidse fremspring, der modtager kemiske beskeder gennem synapser fra andre neuroner.
Peter Wolynes, en teoretisk fysiker ved Rice, sluttede sig til et igangværende samarbejde mellem UH-fysiker Margaret Cheung og UTHs neurobiolog Neal Waxham, der havde til formål at forstå, hvordan signaler trænger igennem dendritter, grenene på nerveceller, der overfører information mellem celler.
At finde den komplette struktur af CaMKII har vist sig at være for kompleks til røntgenkrystallografi, selvom dele af dens struktur var kendt. Når det kombineres med aktinet, der udgør cytoskelettet, systemet blev også det største protein Wolynes og hans team har analyseret via deres protein-struktur forudsigelsesprogram, AWSEM.
Da de var færdige, strukturen forudsagt af computeren var et bemærkelsesværdigt match for todimensionelle elektronmikroskopbilleder af Waxham og hans gruppe, der tydeligt viser parallelle aktinfilamenter holdes sammen, stige-lignende, ved trin af CaMKII.
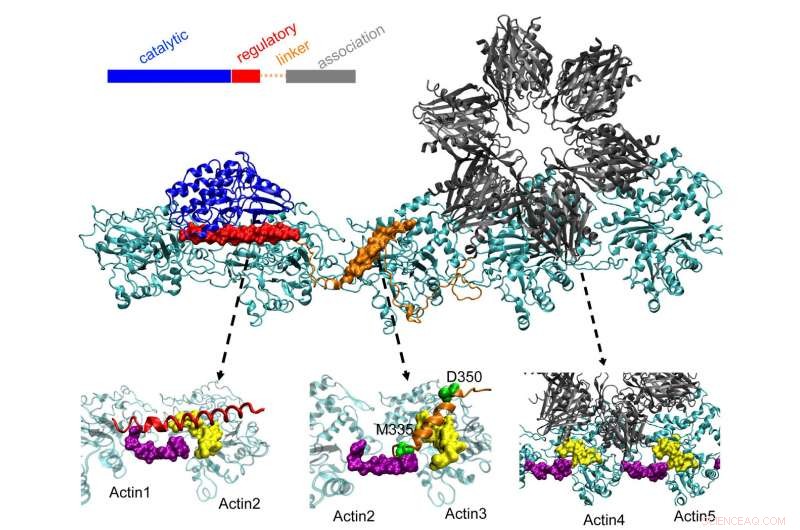
CaMKII-proteinet øverst forankres i tre lommer på snoede aktinfilamenter i neuroner, en proces, som forskere ved Rice University, University of Houston og University of Texas Health Science Center i Houston (UTHealth) mener er vigtigt for at danne langtidshukommelse. Det regulatoriske domæne (rødt) på CaMKII binder sig også til indkommende calmodulinproteiner, som udpakker hele strukturen fra aktin og tillader bundtede filamenter at omorganisere. Kredit:Wolynes Research Lab/Rice University
"Der er helt sikkert foreløbige kemiske trin, der involverer enzymaktiviteten af CaMKII, før du kommer til dette stadie; derfor, vi har ikke et helt klart billede af, hvordan vi skal sætte alt sammen, " sagde Wolynes. "Men det er klart, at samlingen af komplekset er nøgletrinet, hvor kemi bliver til en struktur i større skala, der kan rumme en hukommelse."
CaMKII er unikt egnet til at interagere med actin, det mest udbredte protein i eukaryote celler og et, der har særlige evner i neuroner, hvor det ikke kun skal give tusindvis af dendritter (i hver af milliarder af neuroner) deres hvilende former, men også skal give dem et niveau af plasticitet til at tilpasse sig en konstant byge af signaler.
Actin-molekyler samler sig selv til lange, snoede filamenter. De hydrofobe lommer mellem disse molekyler er perfekt konfigureret til at binde CaMKII, et stort protein med flere dele, eller domæner. Disse domæner låser sig fast på tre på hinanden følgende bindingssteder på filamentet, og snoningerne sætter bindingssteder med jævne mellemrum for at forhindre, at proteinerne hober sig op.
CaMKIIs "associations" domæne er en seksdobbelt underenhed, der også binder til tilstødende filamenter for at danne actinbundter, rygraden af dendritiske rygsøjler, der giver disse fremspring deres former.
Disse bundter forbliver stive, hvis dendritten indeholder lidt calcium. Men når calciumioner kommer ind gennem synapsen, de kombinerer med calmodulin proteiner, giver dem mulighed for at binde sig til en anden del af CaMKII, det floppy regulatoriske domæne. Det udløser adskillelsen af et domæne af CaMKII fra filamentet, efterfulgt af resten af proteinet, åbning af et kort tidsrum, hvor bundterne kan omkonfigureres.
"Når nok calcium kommer ind, det aktiverede calmodulin nedbryder disse strukturer, men kun for et stykke tid, " sagde Wolynes. "Så reformeres cytoskelettet. I det tidsrum, den dendritiske rygsøjle kan antage en anden form, der kan være større."
"Vi ved, at calcium bringer information ind i cellen, "Cheung tilføjede. "Men hvordan nerveceller ved, hvad de skal gøre med det, afhænger virkelig af, hvordan dette protein koder for information. En del af vores arbejde er at forbinde det på et molekylært niveau og derefter projicere, hvordan disse simple geometriske regler udvikler strukturer i større mikroskala."

Et elektronmikroskopbillede viser actinfilamenter holdt sammen i parallelle eller forgrenede arrangementer af CaMKII-proteiner i en neuron. Simuleringer og eksperimenter udført på Rice University, University of Houston og University of Texas Health Science Center i Houston viste, at afstanden mellem tilstødende CaMKII-partikler i komplekserne er næsten fastsat til 36 nanometer. Skalaen er 100 nanometer. Billedet blev lavet i Structural Biology Imaging Center på McGovern Medical School ved UTHealth. Kredit:Waxham Lab/UTHealth
Holdets beregninger viste, at associationsdomænet er ansvarligt for omkring 40 % af proteinets bindingsstyrke til actin. Et linkerdomæne tilføjer yderligere 40 %, og det afgørende regulatoriske domæne giver de sidste 20 % - en fornuftig strategi, da det regulatoriske domæne er på udkig efter indkommende calcium-calmoduliner, der kan pakke hele proteinet ud af filamentet.
Projektet kom sammen gennem Rice's Center for Teoretisk Biologisk Fysik (CTBP), hvoraf Wolynes er meddirektør og Cheung en senior videnskabsmand. Deres forening går tilbage til, da de begge var på University of California, San Diego, han som professor og hun som kandidatstuderende hos risfysiker José Onuchic, også en CTBP-meddirektør. Wolynes tjente også i hendes afhandlingspanel, hun sagde.
Cheung var opmærksom på tidligere arbejde fra Wolynes og hans Rice-gruppe, der foreslog, at actin stabiliserer prionlignende fibre, der menes at kode minder i neuroner, og besluttede, at det var et godt match for hendes forskning med Waxham for at se, hvordan calcium aktiverer CaMKII.
"Dette er et af de mest interessante problemer inden for neurovidenskab:Hvordan fører kortsigtede kemiske ændringer til noget langsigtet, som hukommelse?" sagde Waxham. "Jeg tror, at et af de mest interessante bidrag, vi giver, er at fange, hvordan systemet tager ændringer, der sker på millisekunder til sekunder, og bygger noget, der kan overleve det indledende signal."
Puslespillet er langt fra færdigt, sagde Wolynes. "Det tidligere værk af Margaret og Neal handlede om initieringen af hukommelsesbegivenheder, " sagde han om sine kollegers undersøgelse af calmodulin. "Vores prionpapir handlede om bevarelse af hukommelsen, i slutningen af læringsprocessen. Og aktin er i midten. Der kan være mange andre ting i midten, også.
"Disse store spørgsmål er interessante for mange mennesker, " sagde han. "Dette er et nøgleelement i problemet, men det er tydeligvis ikke slutningen på historien."
 Varme artikler
Varme artikler
-
 Elektrisk neutral radikal:Et stærkt kemisk reduktionsmiddel, når det udsættes for lysMekanistiske undersøgelser af Mes-Acr radikal. Kredit: Natur (2020). DOI:10.1038/s41586-020-2131-1 Et kombineret team af forskere fra University of North Carolina ved Chapel Hill og Kent State Un
Elektrisk neutral radikal:Et stærkt kemisk reduktionsmiddel, når det udsættes for lysMekanistiske undersøgelser af Mes-Acr radikal. Kredit: Natur (2020). DOI:10.1038/s41586-020-2131-1 Et kombineret team af forskere fra University of North Carolina ved Chapel Hill og Kent State Un -
 Pålideligt simulerende polyurethanskumPU -udvidelsessimulering med FOAM til fremstilling af en køler. Kredit:Fraunhofer ITWM Autostole, madrasser og isoleringsmaterialer er ofte lavet af polyurethanskum. Opskummingsprocessen for de fl
Pålideligt simulerende polyurethanskumPU -udvidelsessimulering med FOAM til fremstilling af en køler. Kredit:Fraunhofer ITWM Autostole, madrasser og isoleringsmaterialer er ofte lavet af polyurethanskum. Opskummingsprocessen for de fl -
 Forskere finder en ny forbindelse mellem cellemetabolisme og celledelingKredit:CC0 Public Domain Processerne i levende væsener følger en fint orkestreret koreografi ned på molekylært niveau. Rytmiske processer findes overalt i biologien, for eksempel, døgnets døgncykl
Forskere finder en ny forbindelse mellem cellemetabolisme og celledelingKredit:CC0 Public Domain Processerne i levende væsener følger en fint orkestreret koreografi ned på molekylært niveau. Rytmiske processer findes overalt i biologien, for eksempel, døgnets døgncykl -
 Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle
Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle
- Er der en teknologisk løsning på akvatiske dødzoner?
- Atlanterhavet kan få en kickstart fra den anden side af kloden
- Ny skaleringslov forudsiger, hvordan hjul kører over sand
- Sommerfugl stammer fra kvantesimulering
- Hummingbird sæson i Texas
- At tale om sex er akavet, så hvordan kan teenagere bare bede om samtykke?


