Stort fremskridt inden for nanopore-detektion af peptider og proteiner
Nanopore teknologi, som bruges til at sekventere DNA, er billig, håndholdt og arbejder i junglen og i rummet. Brugen af denne teknologi til at identificere peptider eller proteiner er nu et skridt nærmere. Forskere fra University of Groningen har brugt en patenteret nanopore til at identificere fingeraftryk af proteiner og peptider, og det kan endda detektere polypeptider, der adskiller sig med én aminosyre. Resultaterne blev offentliggjort den 16. oktober i tidsskriftet Naturkommunikation .
Forskere fra University of Groningen har været i stand til at identificere en række peptider og proteiner, der passerer gennem en tragtformet nanopore. De har løst to hovedproblemer, der har hæmmet forsøg på at analysere og sekventere proteiner med nanoporer:at få polypeptider ind i porerne og identificere forskelle i proteiner ved at registrere strøm. 'Nanoporer bærer normalt en ladning, og aminosyrerne, der udgør polypeptider, er også ladede. At få polypeptidet ind i poren og passere gennem nanoporer er derfor en udfordring', forklarer lektor i kemisk biologi Giovanni Maglia.
Fingeraftryk
Han brugte en elektro-osmotisk strømning til at trække polypeptiderne ind i porerne. Under et anvendt potentiale på tværs af nanopore, en strøm af ioner og vand passerer gennem poren.' Hvis retningen af ionstrømmen kan styres, en væskestrøm, der er stærk nok til at transportere polypeptider, kan genereres. 'Vi gjorde dette ved at tune ladningerne inde i porevæggen. Ved at ændre mediets pH, det var muligt at finjustere balancen mellem det elektro-osmotiske flow og kraften af det elektriske felt, som blev påført på tværs af poren.'
Maglia testede fem forskellige polypeptider i området fra 1 til 25 kilodalton. "Vi brugte biomarkørpeptider forbundet med sygdom, med forskellige ladninger og former', han siger. Polypeptiderne kom ind i poren, og strømmen over poren producerede et 'fingeraftryk' for hver. Han formåede således at skelne mellem to versioner af det 21 aminosyrer lange peptid endotelin, som kun adskiller sig med én aminosyre (tryptophan eller methionin).
Sekvensering
At få en god læsning fra en nanopore er kompliceret. Maglia brugte en ny slags pore, som han karakteriserede og patenterede. "Tidligere porer er tøndeformede, hvilket betyder, at formen og størrelsen af poren har fundamentale begrænsninger. Men vores pore har en alfa-spiralformet tragtform, og størrelsen af den smalle ende, det er der, vi laver vores målinger, betyder, at den kun skal indeholde én aminosyre, så det er nemmere at indstille.'
I øjeblikket, polypeptiderne passerer gennem poren for hurtigt til at identificere de separate aminosyrer. Dette er nødvendigt for protein sekventering på enkelt-molekyle skala. Det ville være et værdifuldt værktøj til forskning, forklarer Maglia:'Proteiner kan modificeres kemisk på mange unikke måder, og vi har meget lidt information om den nøjagtige sammensætning af proteiner i vores krop.' Dette kan kun ses på enkelt-molekyle niveau.
Maglia:'Molekylær diagnostik og biomarkøropdagelse bør især drage fordel af enkeltmolekylekarakteriseringen af proteomer.' Det er en stor fordel, at der allerede er udviklet nanopore-teknologi til DNA-sekventering. Denne teknologi er hurtig, billig og robust:nanopore-sekventeringsenheder bruges i felten, og en er endda blevet sendt op til den internationale rumstation. Brug af en lignende teknik til at identificere proteiner ville kræve mindre tilpasninger, hovedsageligt i porerne. 'I teorien, vi kunne bygge en ansøgning i morgen.'
 Varme artikler
Varme artikler
-
 Kaotiske strømme og livets oprindelseKaotisk advektion accelererer grænsefladetransport under hydrotermisk relevante forhold Kredit: Proceedings of the National Academy of Sciences Et forskerhold ved Texas A&M University har afsløre
Kaotiske strømme og livets oprindelseKaotisk advektion accelererer grænsefladetransport under hydrotermisk relevante forhold Kredit: Proceedings of the National Academy of Sciences Et forskerhold ved Texas A&M University har afsløre -
 En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der
En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der -
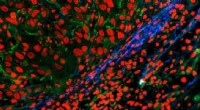 Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi
Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi -
 Sådan beregnes teoretiske udbytterEt teoretisk udbytte er den mængde produkter, der er skabt ved en kemisk reaktion, forudsat at ingen af reaktanterne blev spildt, og reaktionen var fuldstændigt afsluttet. At kende det teoretiske ud
Sådan beregnes teoretiske udbytterEt teoretisk udbytte er den mængde produkter, der er skabt ved en kemisk reaktion, forudsat at ingen af reaktanterne blev spildt, og reaktionen var fuldstændigt afsluttet. At kende det teoretiske ud
- Fodgængere ved kryds og tværs fandt at følge Levy walk -processen
- Sommende natrium kunne forklare asteroide Phaethons kometlignende aktivitet
- Dårlige nyheder bliver til hysteri i folkemængderne, viser ny forskning
- Forskere rapporterer de tidligste fossile fodaftryk
- North Pacific Subtropical High-modeller forudsiger sommermonsuner, reducerede tyfoner i land
- Mandlige ph.d.-kandidater tjener mere, mere tilbøjelige til at have fast job end kvindelige kollege…


