Ny røntgenspektroskopi udforsker brint-genererende katalysator
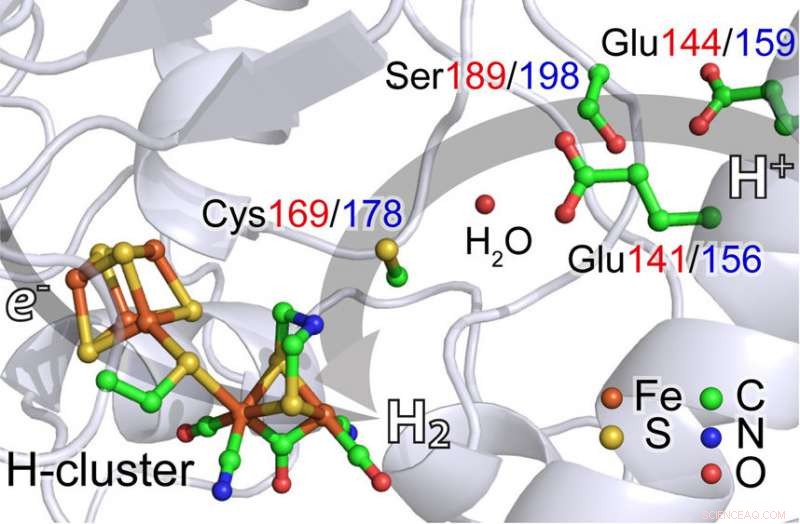
Ved at bruge en nyudviklet teknik og en af verdens mest avancerede røntgenkilder, forskere fra Japan, Tyskland og USA studerer enzymer, der kan producere brintgas. At forstå disse reaktioner kan være vigtigt i udviklingen af en ren brændstoføkonomi drevet af brint. Kredit:Cramer Lab, UC Davis
Ved hjælp af en nyudviklet teknik, forskere fra Japan, Tyskland og USA har identificeret et nøgletrin i produktionen af brintgas af et bakterielt enzym. At forstå disse reaktioner kan være vigtigt i udviklingen af en ren brændstoføkonomi drevet af brint.
Holdet studerede hydrogenaser - enzymer, der katalyserer produktion af hydrogen fra to vidt udbredte organismer: Chlamydomonas reinhardtii , en enkeltcellet alge og Desulfovibrio desulfuricans, en bakterie.
I begge tilfælde deres hydrogenase-enzymer har et aktivt sted med to jernatomer.
"Blandt hydrogenaser, [FeFe]-hydrogenase har den højeste omsætningshastighed (molekylær brintproduktionshastighed) og har derfor en potentiel rolle i fremtidens brintøkonomi, enten ved direkte anvendelse eller ved et syntetisk kompleks, som har et lignende reaktionscenter, " sagde professor Stephen P. Cramer i UC Davis Department of Chemistry og medforfatter på papiret sammen med kandidatstuderende Cindy C. Pham (med-førsteforfatter) og Nakul Mishra og projektforsker Hongxin Wang i samme afdeling.
Forskerne brugte en teknik kaldet nuclear resonant vibrational spectroscopy (NRVS) til at følge vibrationsstrukturerne og analyseaktiviteten ved jernatomerne i enzymet. NRVS kræver specialudstyr, og er i øjeblikket kun tilgængelig på fire steder i verden:SPring-8 synkrotronen i Hyogo, Japan, hvor denne undersøgelse blev udført; den avancerede fotonkilde ved Argonne National Laboratory, Illinois; European Synchrotron Radiation Facility i Grenoble, Frankrig; og Petra-III i Hamborg, Tyskland.
Den encellede grønalge Chlamydomonas reinhardtii har et jernbaseret enzym, der kan generere brintgas. Kredit:JGI
Ved hjælp af NRVS, holdet kunne vise, at jernatomerne kortvarigt danner et hydrid (jern-brint), før de frigiver molekylært hydrogen (H2). Det er det første vellykkede eksperiment af sin type på naturligt forekommende [FeFe]-hydrogenaser, sagde Wang.
"Det vellykkede resultat af denne forskning skyldes det brede samarbejde mellem biokemikere, spektroskoper, eksperimentelle fysikere og teoretikere, " sagde Wang. "Dette starter en rejse for at forfølge jernspecifik information for alle mellemprodukterne i [FeFe] hydrogenase i fremtiden."
Yderligere forfattere på papiret, offentliggjort online i Journal of the American Chemical Society er:Vladimir Pelmenschikov, Tekniske Universitet i Berlin, Tyskland; James Birrell, Constanze Sommer, Edward Reijerse og Wolfgang Lubitz, Max Planck Institute for Chemical Energy Conversion, Mülheim an der Ruhr, Tyskland; Casseday Richers og Thomas Rauchfuss, University of Illinois; Kenji Tamasaku og Yoshitaka Yoda, SPRING-8, Hyogo, Japan. Arbejdet blev delvist støttet af tilskud fra National Institutes of Health og Max Planck Society.
 Varme artikler
Varme artikler
-
 Effekten af eddike på kyllingebenCalcium- og fosfatmineraler kombineres for at holde knoglerne stærke og stive. Blødgøring af kyllingeben i eddike i flere dage efterlader knoglerne bløde og gummiagtige. Den sure komponent i eddike
Effekten af eddike på kyllingebenCalcium- og fosfatmineraler kombineres for at holde knoglerne stærke og stive. Blødgøring af kyllingeben i eddike i flere dage efterlader knoglerne bløde og gummiagtige. Den sure komponent i eddike -
 Livets oprindelse:Kemisk udvikling i en lille golfstrømVarme væsker møder et koldt hav:Lokale temperaturgradienter i porøse vulkanske sten på den tidlige Jord kunne have lettet selvreplikationen af RNA-strenge. Kredit:Picture Alliance Kemiske reakti
Livets oprindelse:Kemisk udvikling i en lille golfstrømVarme væsker møder et koldt hav:Lokale temperaturgradienter i porøse vulkanske sten på den tidlige Jord kunne have lettet selvreplikationen af RNA-strenge. Kredit:Picture Alliance Kemiske reakti -
 Styrker lægemiddelopdagelsen ved at evaluere antivirale midler i tusindvis af enkeltcellerEn forbedret mikrofluidisk enhed giver forskere mulighed for samtidig at observere tusindvis af individuelle celler, der er inficeret med virus. Et nærbillede af enheden viser 18 brønde, hver indehold
Styrker lægemiddelopdagelsen ved at evaluere antivirale midler i tusindvis af enkeltcellerEn forbedret mikrofluidisk enhed giver forskere mulighed for samtidig at observere tusindvis af individuelle celler, der er inficeret med virus. Et nærbillede af enheden viser 18 brønde, hver indehold -
 Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og
Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og
- Fager et effektivt alternativ til brugen af antibiotika i akvakultur
- Vandkraftdæmninger køler floder i Mekong-flodens bassin, viser satellitter
- Sagen for økonomi - ved tallene
- Byer opfordres til at arbejde sammen med forskere om klimaændringer
- Kvinders arbejde:Hvordan coronavirus for altid kan ændre den måde, vi bekymrer os om inden for fam…
- Fra dating deltagere til sørgende enker, Facebook satser stærkt på underholdning, men vil folk se…


