Ny struktur af nøgleprotein rummer spor for bedre lægemiddeldesign
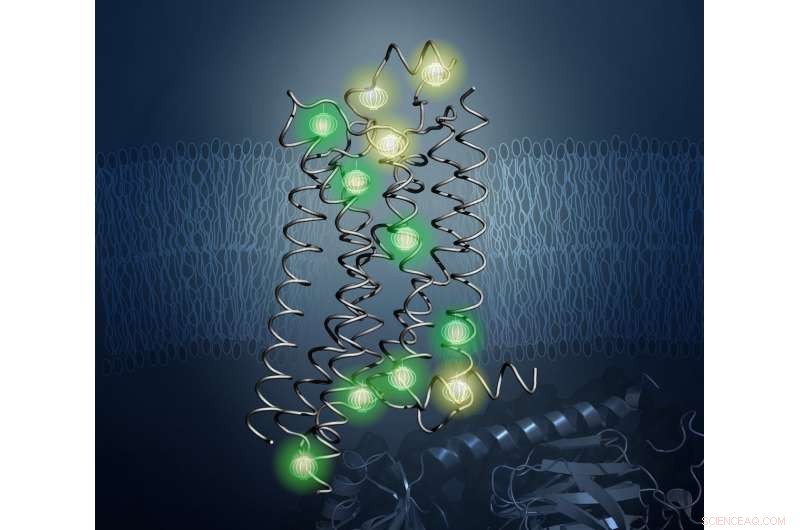
Prober (vist glødende her) afslørede den indre arkitektur af proteinet A2aAR i den nye undersøgelse. Kredit:Kurt Wuthrich og Matthew Eddy, Scripps Research Institute
Forskere ved The Scripps Research Institute (TSRI) har kigget dybt ind i hjertet af et nøgleprotein, der bruges i lægemiddeldesign, og opdaget dynamiske strukturelle funktioner, der kan føre til nye måder at målrette sygdomme på. Proteinet, kaldet A 2A adenosinreceptor (A 2a AR), er medlem af G-proteinkoblede receptorfamilien (GPCR), som er målene for omkring 40 procent af alle godkendte lægemidler.
Den nye, mere detaljeret billede af A 2a AR's signalmekanisme afslører nøgledele af dens indre funktion, herunder en aminosyre, der fungerer som en "omskifter" til at styre signalering over cellemembranen.
"Denne grundlæggende viden er potentielt nyttig til at forbedre lægemiddeldesign, siger nobelpristageren Kurt Wthrich, PhD, Cecil H. og Ida M. Green professor i strukturel biologi ved TSRI og seniorforfatter af undersøgelsen.
Resultaterne blev offentliggjort i dag i tidsskriftet Celle .
Billedteknik afslører, hvordan protein ændrer form
Alle menneskelige celler indeholder A 2a AR og andre GPCR'er indlejret i deres plasmamembran. Mere end 800 GPCR'er er blevet opdaget i den menneskelige krop, og hver har en rolle i at regulere en kropsfunktion. For eksempel, EN 2a AR regulerer blodgennemstrømning og inflammation og medierer virkningerne af koffein. EN 2a AR er også et valideret mål til behandling af Parkinsons sygdom og et relativt nyt mål til målretning mod cancer.
"GPCR'er gør næsten alt, hvad du kan forestille dig, " siger Wthrich. "Men i lang tid, lægemiddeldesign blev udført uden at vide, hvordan GPCR'er så ud."
Til den nye undersøgelse, forskerne sigtede efter bedre at forstå forholdet mellem A 2a AR-funktion og dynamiske ændringer i dens struktur for at hjælpe med at informere lægemiddeldesign.
Forskningen byggede på tidligere undersøgelser, hvor forskere brugte en billedbehandlingsteknik kaldet røntgenkrystallografi til at bestemme A 2a AR's tredimensionelle struktur. Billederne viste, at A 2a AR ligner en kæde, der krydser cellemembranen og har en åbning på den side, der vender ud af cellen. Den region af GPCR-strukturen, der stikker ud af membranen, interagerer med lægemidler og andre molekyler for at signalere til partnerproteiner inde i cellen.
Selvom krystalstrukturer gav en nøgleoversigt over receptorens form i inaktive og aktiv-lignende tilstande, de kunne ikke vise bevægelse og ændringer i strukturen, når A 2a AR møder nye forpligtende partnere, såsom lægemiddelkandidater. Kort sagt, forskerne i den nye undersøgelse havde brug for at undersøge, hvorfor A 2a AR fungerer som den gør.
For at løse dette problem, forskerne brugte en teknik kaldet nuklear magnetisk resonans (NMR) spektroskopi, som skaber stærke magnetiske felter for at lokalisere probernes positioner i en prøve. Wthrich er en verdenskendt leder inden for NMR-området og vandt Nobelprisen i kemi i 2002 for banebrydende arbejde inden for NMR for at studere strukturerne af biologiske molekyler. Med NMR, forskere kan bestemme strukturerne af proteiner og studere deres dynamiske egenskaber i opløsning ved fysiologiske temperaturer - den måde, de eksisterer i den menneskelige krop.
I arbejde ledet af TSRI's Matthew Eddy, PhD, første forfatter til den nye undersøgelse, forskerne brugte NMR til at observere A 2a AR i mange forskellige konformationer, kaste lys over, hvordan det ændrer form på overfladen af menneskelige celler som reaktion på lægemiddelbehandlinger.
Vigtigt, NMR lod holdet visualisere ændringer i den interne arkitektur af A 2a AR. Dette førte dem ud over tidligere NMR-undersøgelser med løsning, som fokuserede på den teknisk mindre krævende observation af NMR-observerbare prober knyttet til fleksible dele af GPCR'er, for det meste placeret ved eller nær overfladen af receptoren. Tilgangen i det nye studie gjorde det muligt for forskere at følge virkningerne af lægemiddelbinding på den ekstracellulære overflade på ændringer i proteinstruktur og dynamik på den intracellulære overflade - det strukturelle grundlag for signaloverførsel - på tværs af hjertet af GPCR.
Det var som om forskerne havde set en bil, og med NMR, de kunne endelig inspicere dens motor.
At genoverveje, hvordan vi designer lægemidler
To detaljer i A 2a AR's struktur gav forskerne indsigt i, hvordan fremtidige lægemidler kunne manipulere receptoren. Et nøglefund var, at udskiftning af en bestemt aminosyre i receptorens centrum ødelagde receptorens evne til at sende signaler ind i cellen.
"Med dette fund, vi kan sige 'A-ha! Det er denne ændring i strukturen, der dræber signalaktiviteten.' Måske kan vi lave en ændring i et lægemiddel for at overvinde denne grænse, " siger Wthrich.
Forskerne afslørede også aktiviteten af en "vippekontakt" i A 2a AR. Tidligere undersøgelser antydede, at en af tryptofan-aminosyrerne i A 2a AR vipper op og ned sammen med A 2a AR's aktivitet. Med NMR, forskerne observerede direkte denne unikke tryptofan, da den ændrede retning som reaktion på forskellige lægemidler. Kemikere kunne potentielt modificere lægemidler for at manipulere denne kontakt og kontrollere A 2a AR-signalering.
Forskerne understreger, at denne nye undersøgelse er potentielt relevant for en stor del af den store familie af GPCR'er. Faktisk, strukturelle detaljer fra denne undersøgelse kunne gælde for mere end 600 "klasse A" GPCR'er i vores kroppe.
Ud over Wthrich og Eddy, forfatterne til undersøgelsen, "Allosterisk kobling af lægemiddelbinding og intracellulær signalering i A 2a Adenosin receptor, " were Tatiana Didenko and Pawel Stanczak of The Scripps Research Institute; Reto Horst of The Scripps Research Institute and Pfizer Worldwide Research and Development; Zhan-Guo Gao and Kenneth A. Jacobson of the National Institutes of Health; and Ming-Yue Lee, Kyle M. McClary, Gye Won Han, Martin Audet, Kate L. White and Raymond C. Stevens of the University of Southern California.
 Varme artikler
Varme artikler
-
 Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr
Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr -
 Bærbare sensorer, der registrerer gaslækagerKredit:Pohang University of Science &Technology (POSTECH) Gasulykker såsom giftig gaslækage på fabrikker, kulilte lækage af kedler, eller kvælning af giftig gas under rensning af mandehuller forts
Bærbare sensorer, der registrerer gaslækagerKredit:Pohang University of Science &Technology (POSTECH) Gasulykker såsom giftig gaslækage på fabrikker, kulilte lækage af kedler, eller kvælning af giftig gas under rensning af mandehuller forts -
 Omfattende elektroniske strukturmetoder til materialedesignEt stort antal kandidatmaterialer er valgt fra eksperimentelle eller beregningsmæssige databaser, og en sekvens af screeningsberegninger reducerer deres antal ned til et lille sæt af kandidater med de
Omfattende elektroniske strukturmetoder til materialedesignEt stort antal kandidatmaterialer er valgt fra eksperimentelle eller beregningsmæssige databaser, og en sekvens af screeningsberegninger reducerer deres antal ned til et lille sæt af kandidater med de -
 Hvordan bakterier producerer manganoxid-nanopartiklerForskere studerede strukturen af et rekombinant enzym, der er ansvarlig for biomineralisering af Mn, give ledetråde til potentiel miljøsanering eller bioenergiproduktion. Kredit:Environmental Molecu
Hvordan bakterier producerer manganoxid-nanopartiklerForskere studerede strukturen af et rekombinant enzym, der er ansvarlig for biomineralisering af Mn, give ledetråde til potentiel miljøsanering eller bioenergiproduktion. Kredit:Environmental Molecu
- Nano parfait en godbid for videnskabsmænd
- At fylde op for at forberede sig på en krise er ikke panikkøb
- Forskere udgiver en oversigtsartikel om fysikken i interagerende partikler
- En lipidfælde inde i celler reducerer lægemidlets effektivitet
- Ændringer i skrivestil giver ledetråde til gruppens identitet
- Mekanismen bag de elektriske ladninger genereret af fotosyntese


