Et spørgsmål om mobilitet:Tværfagligt papir foreslår ny strategi for lægemiddelopdagelse
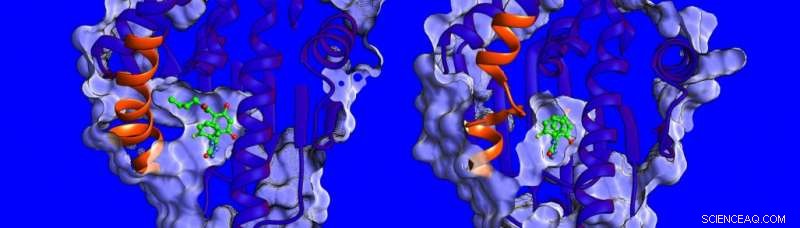
Forskelle i strukturen og dynamikken i den spiralformede region (vist i orange) af HSP90-proteinet. Kredit:Heidelberg Institut for Teoretiske Studier
En fælles industri/akademiske undersøgelse af et cancermålprotein afslører en usædvanlig sammenhæng mellem bindingsstedsfleksibilitet og lægemiddelmållevetid. Resultaterne, udgivet i Naturkommunikation , foreslå en ny strategi for opdagelse af lægemidler. Forskningen blev udført inden for rammerne af Kinetics for Drug Discovery K4DD-konsortiet, støttet af Innovative Medicines Initiative.
De fleste lægemidler udøver deres terapeutiske virkning ved at binde sig til et målproteinmolekyle, derved forstyrrer proteinets normale funktion. Traditionelt, det er blevet anset, at jo tættere et lægemiddel binder sit målprotein, dvs. jo større dens bindingsaffinitet er, jo mere effektivt vil det være. Imidlertid, stoffer skal fungere i levende organismers konstant skiftende miljø. Det er derfor i stigende grad anerkendt, at ikke kun bindingsaffinitet og termodynamik, men også lægemiddelmålopholdstider og kinetik skal optimeres under lægemiddelopdagelsesprocessen.
Kinetik sat på prøve:At studere et kræftmål
Et tværfagligt team af forskere fra K4DD partnere Merck KGaA (Darmstadt), Heidelberg Institut for Teoretiske Studier (HITS), og Instituto de Biologia Experimental e Tecnológica (iBET) (Lissabon), anvendte state-of-the-art eksperimentelle og beregningsmæssige tilgange til at undersøge determinanterne for målopholdstider for et sæt inhibitorer af et bredt undersøgt cancermål, varmechokprotein 90 (HSP90). HSP90-hæmmere kan forstyrre cellecyklussen og potentielt stoppe tumorvækst. Holdet har for nylig offentliggjort nogle af deres resultater i Naturkommunikation .
Overraskende resultater:Større bindingsstedmobilitet fører til længere opholdstider
"I øjeblikket, der er lidt kendt om de faktorer, der påvirker opholdstider for lægemiddelmål, så vi besluttede at måle bindingstermodynamikken og kinetikken, løse strukturerne af HSP90-hæmmerkomplekser og simulere deres dynamik, " siger Dr. Marta Amaral, en af de tilsvarende forfattere. Strukturerne bestemt ved røntgenkrystallografi viser, at bindingslommen på HSP90 er foret med et område, der kan tage form af en helix eller en løkke, når den er bundet til forskellige inhibitorer (se billedet nedenfor).
Forskerne fandt ud af, at forbindelser, der binder med en tilstedeværende helix, binder i længere tid. "Vi var virkelig overraskede, " siger prof. Rebecca Wade (HITS), "da vi fandt ud af, at en vigtig bidragyder til de lange opholdstider var den større mobilitet af den spiralformede region af bindingslommen, når inhibitoren bandt." Denne usædvanlige bindingsmekanisme åbner en ny vej for lægemiddeldesign:Forskere kan overveje mindre stive proteinmål og identificere molekyler, der stabiliserer mere mobile former af proteinet ved binding - lidt som en skistøvle med en tilpasningsdygtig inderforing, der konstant tilpasser sig foden. Resultaterne af denne undersøgelse antyder en ny måde at finde mere effektive lægemiddelkandidater med optimale kinetiske og termodynamiske egenskaber.
 Varme artikler
Varme artikler
-
 Forskning nulstilling på elektronisk næse til overvågning af luftkvalitet, diagnosticering af syg…Afbildning af et gassensorarray sammensat af mikroskalabalancer belagt med tynde film af nanoporøse materialer kaldet metalorganiske rammer. Kredit:Arni Sturluson, Melanie Huynh, OSU Ingeniørhøjskole
Forskning nulstilling på elektronisk næse til overvågning af luftkvalitet, diagnosticering af syg…Afbildning af et gassensorarray sammensat af mikroskalabalancer belagt med tynde film af nanoporøse materialer kaldet metalorganiske rammer. Kredit:Arni Sturluson, Melanie Huynh, OSU Ingeniørhøjskole -
 Tryk giver den bedste afkølingMCE:magnetoklaorisk effekt; ECE:elektrokalorisk effekt; eCE:elastokalorisk effekt; BCE:barokalorisk effekt. Plastkrystallerne identificeret i dette arbejde er neopentylglycol (NPG), pentaglycerin (PG)
Tryk giver den bedste afkølingMCE:magnetoklaorisk effekt; ECE:elektrokalorisk effekt; eCE:elastokalorisk effekt; BCE:barokalorisk effekt. Plastkrystallerne identificeret i dette arbejde er neopentylglycol (NPG), pentaglycerin (PG) -
 Forskere udtænker en ny metode til at få bly ud af filtre, bedre måle mængden i postevandForskere i laboratoriet af Daniel Giammar, Walter E. Browne professor i miljøteknik i McKelvey School of Engineering, har udtænkt en ny metode, der giver dem mulighed for at udtrække bly fra point-of-
Forskere udtænker en ny metode til at få bly ud af filtre, bedre måle mængden i postevandForskere i laboratoriet af Daniel Giammar, Walter E. Browne professor i miljøteknik i McKelvey School of Engineering, har udtænkt en ny metode, der giver dem mulighed for at udtrække bly fra point-of- -
 Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg
Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg
- Robotgribere i Spider-Man-stil trodser tyngdekraften
- Beregning af omkostningseffektiv bevarelse
- Robotter navigerer autonomt under jorden i DARPA-udfordringen
- Forskere dokumenterer koraltab og langsomme tegn på bedring i det centrale Stillehav
- Hvordan fungerer skudsikkert glas?
- Franske anklagere vil have Air France prøvet i 2009 -styrtet i Rio


