Bånd der binder, og kan løsnes
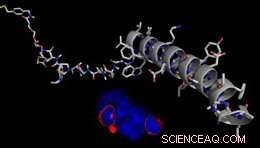
Model af en REductively Cleavable AgONist (RECON) til reversibel kontrol af GPCR-afhængige cellesignalveje. Kredit:J. Broichhagen, D. Hodson
LMU-forskere har udviklet en metode, der gør det muligt at tænde og slukke for celleoverfladereceptorer efter ønske. Teknikken lover at give ny indsigt i receptorfunktioner og deres virkninger på intracellulære signalveje.
G-proteinkoblede transmembrane receptorer (GPCR'er) er tæt involveret i reguleringen af en lang række biologiske processer. De virker ved at binde ekstracellulære budbringermolekyler - såsom hormoner - og aktivere intracellulære signalrelæer, der ændrer cellefunktioner på specifikke måder. Ikke overraskende, funktionelle defekter i disse membranbundne receptorer fører ofte til kroniske fysiologiske lidelser. Dette forklarer, hvorfor en stor del af den nuværende farmakologiske forskning fokuserer på at finde lægemidler, der er rettet mod specifikke GPCR'er. Et forskningssamarbejde, der involverer grupper ledet af professorerne Anja Hoffmann-Röder (professor i organisk kemi) ved LMU, Dirk Trauner (tidligere LMU, nu ved New York University) og David Hodson (University of Birmingham) har nu designet en suite af molekyler, med hvilke GPCR'er (og potentielt andre receptortyper) kan aktiveres og deaktiveres farmakologisk efter behag. Disse midler lover at afdække nye aspekter af de molekylære mekanismer, der ligger til grund for receptorernes handlinger, og ved at gøre dette bør det lette udviklingen af nye terapeutiske strategier. De nye resultater vises i online-journalen ACS Central Science .
Det nye studie er baseret på tidligere arbejde, hvor teamet havde udviklet et lysafhængigt farmakologisk system ved hjælp af 'SNAP-tags'. Et SNAP-tag er et bindende protein, der kan introduceres til et målreceptorprotein ved hjælp af genetiske midler. Dens formål er at fungere som et bindingssted for vedhæftning af en syntetisk ligand, som så kan modulere receptorsignalering, dvs. aktivere eller blokere aktivering. Det nye papir beskriver anvendelsen af denne teknik på en receptor kaldet GLP-1R, som regulerer udskillelsen af insulin. Det er derfor et attraktivt mål for udviklingen af lægemidler til behandling af diabetes. "Vi brugte som ligand et naturligt hormon, der var udstyret med en syntetisk forlængelse, der fungerer som en adapter, der er kovalent bundet af SNAP-tagget. Binding af hormonet aktiverer receptoren, mens den direkte fastgørelse af adapteren til SNAP-tag'et sikrer, at receptoren holdes i ON-tilstand, " forklarer Tom Podewin (Max Planck Institute for Medical Research), fælles førsteforfatter på det nye studie og indtil 2017 ph.d.-studerende i Hoffmann-Röders gruppe. Fastgørelse af adapterenden til SNAP-mærket binder effektivt liganden til receptoren. Imidlertid, adapteren er fleksibelt forbundet til receptorens hormonbindingssted via en disulfidbinding, som let kan brydes ved tilsætning af et reduktionsmiddel. Dette trick tillader hormonet at blive frigivet fra dets bindingssted, dermed vende interaktionen og slukke for receptoren igen.
For at demonstrere alsidigheden af denne 'tethered pharmacology'-tilgang, holdet brugte en anden syntetisk ligand til at aktivere en receptor, der styrer sekretionen af væksthormon. "Vores ligander er faktisk de største kendte bundne molekyler, der har vist sig at fungere som aktivatorer eller agonister for membranbundne receptorer. Dette beviser, at bundet farmakologi ikke er begrænset til brugen af små molekyler, men kan udvides til peptider og måske endda til proteiner, " påpeger Hoffmann-Röder.
Da binding til SNAP-tagget er kovalent, den aktiverende ligand kan ikke let frigives fra receptoren i fravær af et reduktionsmiddel. Normalt, aktiverede GPCR'er fjernes omgående fra cellemembranen og transporteres til intracellulære vesikler. Når først der, deres ligander dissocierer, og de recirkuleres derefter til celleoverfladen. Imidlertid, forskerne fandt – til deres overraskelse – at binding af den syntetiske ligand hæmmer denne genbrugsproces, fanger receptoren i vesiklen. "Evnen til varigt at binde enhver ligand - det være sig et farmakologisk middel eller et tag til brug i bio-imaging - til en passende modificeret receptor giver nye muligheder for manipulation og karakterisering af komplekse signalveje i celler, " tilføjer fælles førsteforfatter Johannes Broichhagen. Han og hans kolleger mener, at den nye metode vil give en bedre forståelse af receptorer og deres funktioner, hvilket utvivlsomt vil få konsekvenser for lægemiddeludviklingen i fremtiden.
 Varme artikler
Varme artikler
-
 Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer
Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer -
 Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser -
 Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de
Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de -
 Aktiv læring fremskynder redox-flow batteri opdagelseSømløse interaktioner mellem kvantemekaniske simuleringer og kunstig intelligens kunne give en effektiv materialeopdagelsesplatform. Kredit:Rajeev Surendran Assary / Argonne National Laboratory Ve
Aktiv læring fremskynder redox-flow batteri opdagelseSømløse interaktioner mellem kvantemekaniske simuleringer og kunstig intelligens kunne give en effektiv materialeopdagelsesplatform. Kredit:Rajeev Surendran Assary / Argonne National Laboratory Ve
- Forskere bruger standard kontorscanner som et værktøj til jordfarveevaluering
- Skinwalker er ingen ren varulv
- Nanopartikelorientering tilbyder en måde at forbedre lægemiddellevering på
- Forenede medarbejdere har en bedre balance mellem arbejdsliv og privatliv
- Prøv disse 5 daglige vaner for at forbedre dit liv i år
- Racisme, valg overhale COVID-19 som usikre nyheder på populære sociale sider


