Forskere etablerer krystalstruktur af gastrisk protonpumpe
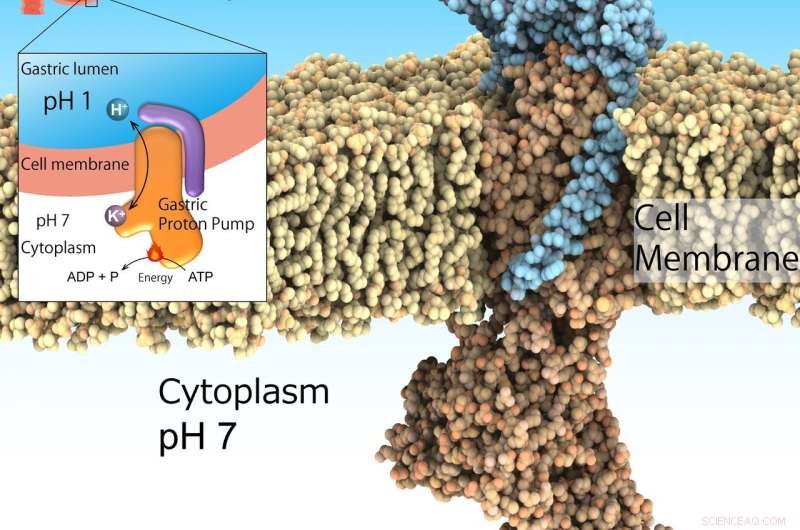
Den gastriske protonpumpe, også kendt som H+, K+-ATPase, udtrykkes på overfladen af maven for at udskille mavesyren, der er uundværlig for fordøjelsen af proteiner i maden. Imidlertid, for meget syreudskillelse fremkalder sår. Den gastriske protonpumpe optager protoner fra det neutrale cytoplasma (pH 7) til det sure miljø i maven (pH 1) drevet af ATP som energikilde. Dermed, det er et vigtigt lægemiddelmål for syrerelaterede sygdomme. Kredit:Kazuhiro Abe
Det meget sure miljø i maven er afgørende for fordøjelsen. Desuden, det fungerer som en vigtig barriere for invasive patogener. Imidlertid, overdreven forsuring af maven fører til sår. Selvom dette ikke er en livstruende tilstand, det kan påvirke helbredet for de berørte personer betydeligt. Syredæmpning i kombination med antibiotika er den anerkendte behandling for at udrydde bakterierne Helicobacter pylori, en risikofaktor for mavekræft. Dette miljø med pH1 reguleres af gastrisk H + , K + -ATPase, en klasse af enzymer, der katalyserer H + transport fra neutral cytosolopløsning (pH 7) til det sure mave-lumen (pH 1) drevet af cellulær energikilde ATP. Derfor, gastrisk H + , K + -ATPase er fremtrædende mål for lægemidler, der behandler overskydende mavesyresekretion.
Det vigtigste forskningsspørgsmål i dette studieområde er, hvordan et så stærkt surt miljø kan opnås i maven. For at besvare dette spørgsmål, forskerne søgte strukturen af H + , K + -ATPase. Holdet offentliggjorde for nylig deres resultater i Natur .
"I vores undersøgelse, vi brugte røntgenkrystallografi til at bestemme strukturerne af gastrisk H + , K + -ATPase bundet til to protonpumpehæmmere, vonoprazan og SCH28080, ", forklarer førsteforfatter Kazuhiro Abe. "Denne information er vigtig for både forfining af eksisterende lægemidler og opdagelsen af nye lægemidler."
Røntgenkrystallografi er en teknik, der bruger røntgendiffraktionsmønstre til at bestemme høj opløsning, tredimensionelle strukturer af molekyler såsom proteiner, små organiske molekyler, og materialer.
Holdet løste med succes krystalstrukturen af H + , K + -ATPase i kompleks med enten vonoprazan eller SCH28080 til en opløsning på 2,8 Å - høj nok til at afsløre, at lægemidlerne delvist overlappede, men havde klart distinkte bindingsmåder i deres bindingssteder fundet i midten af en ledning, der løber fra gastrisk lumen til kationen -bindingssted.
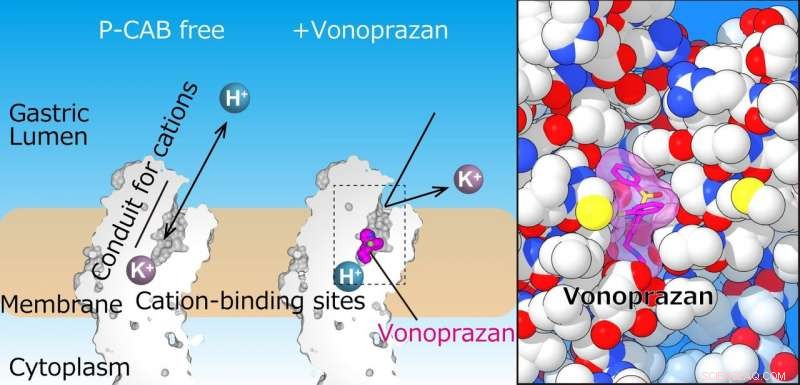
Den gastriske protonpumpe eksporterer H+ ind i mavesækkens lumen, som følger optagelse af K+ i cytoplasmaet. Venstre panel viser udsnit af det transmembrane domæne af den gastriske protonpumpe. I den nuværende struktur, P-CAB (vonoprazan, magenta) binder sig i midten af kationtransportvejen (kanalen), som blokerer kationtransport. Det forstørrede billede af vonoprazan (magenta) bindingssted afslører dets tætte binding til proteinet (højre). Kredit:Kazuhiro Abe
"Krystalstrukturerne tyder på, at den stramme konfiguration ved kationbindingsstedet sænker pKa-værdien (et mål for syrestyrke) af glutaminsyre ved rest 820 tilstrækkeligt til at muliggøre frigivelse af en proton selv ind i pH 1-miljøet i maven, " siger seniorforfatter Yoshinori Fujiyoshi. "Disse strukturer definerer den molekylære interaktion mellem P-CAB'er (K) + -konkurrerende syreblokkere) og H + , K + -ATPase, og afsløre, hvordan H + , K + -ATPase udviser H + ind i maven selv ved pH1. Sådan information vil bidrage væsentligt til videnbasen for lægemiddelopdagelse for tilstande relateret til overdreven maveforsuring."
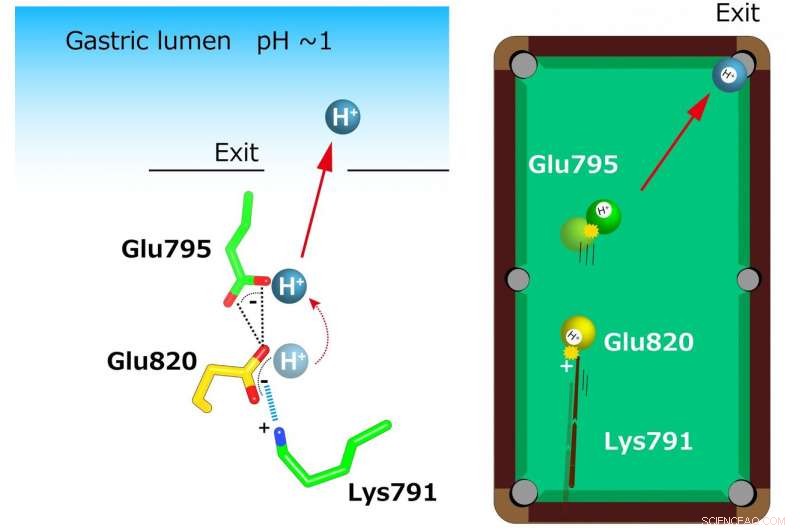
Usædvanlig stram koordination af to glutamater (Glu795 og Glu820) og en lysin (Lys791) ved kationbindingsstedet blev afsløret i krystalstrukturen. Et enkelt H+ bundet til Glu820 ekstruderes af den positive ladning af Lys791, selv for det meget sure gastriske lumen (til venstre). Denne mekanisme sammenlignes med en billardmodel (til højre). En positiv ladning ved lysinresten fungerer som et "signal", der skyder den "gule kugle" (H+) mod Glu820. Denne gule bold rammer igen en anden H+ (grøn bold) ved Glu795, som er udsat for kationtransportvejen. Endelig, en enkelt kugle (H+) er i lommen (udgang til gastrisk lumen). Kredit:Kazuhiro Abe
 Varme artikler
Varme artikler
-
 Liste over atomteorierAtomteori har udviklet sig siden oldtiden. Forskere har taget hypotesen fra græske videnskabsmænd og har bygget videre på den med deres forskellige opdagelser og teorier vedrørende atomet, som stammer
Liste over atomteorierAtomteori har udviklet sig siden oldtiden. Forskere har taget hypotesen fra græske videnskabsmænd og har bygget videre på den med deres forskellige opdagelser og teorier vedrørende atomet, som stammer -
 Opdagelse af en ny strukturfamilie af oxid-ion-ledere SrYbInO4Strukturfeltkortet viser 209 forskellige sammensætninger af M2MO4-forbindelser, hvor det røde skraverede område repræsenterer strukturfeltet af CaFe2O4-typen. Den nyligt syntetiserede forbindelse SrYb
Opdagelse af en ny strukturfamilie af oxid-ion-ledere SrYbInO4Strukturfeltkortet viser 209 forskellige sammensætninger af M2MO4-forbindelser, hvor det røde skraverede område repræsenterer strukturfeltet af CaFe2O4-typen. Den nyligt syntetiserede forbindelse SrYb -
 Kemikere bruger teknologi til at afkode sproget for lipid-protein-interaktionMembranproteinprøver infunderes i massespektrometrien ved hjælp af nanoflow elektrospray-ionisering (nESI). I dette kunstværk, frie og lipidbundne membranproteiner dukker op fra dråber i nESI-processe
Kemikere bruger teknologi til at afkode sproget for lipid-protein-interaktionMembranproteinprøver infunderes i massespektrometrien ved hjælp af nanoflow elektrospray-ionisering (nESI). I dette kunstværk, frie og lipidbundne membranproteiner dukker op fra dråber i nESI-processe -
 Kemikere forenkler syntesen af antitumorforbindelserKredit:RUDN Universitet En RUDN-kemiker i samarbejde med kolleger fra N.D. Zelinsky Institute of Organic Chemistry og N.K. Koltsov Institut for Udviklingsbiologi (IDB), RAS har udviklet en ny meto
Kemikere forenkler syntesen af antitumorforbindelserKredit:RUDN Universitet En RUDN-kemiker i samarbejde med kolleger fra N.D. Zelinsky Institute of Organic Chemistry og N.K. Koltsov Institut for Udviklingsbiologi (IDB), RAS har udviklet en ny meto
- Strækbart, gennemsigtig varmelegeme lavet af metallisk glas
- Fra 3-D til 2-D og tilbage:reversibel omdannelse af lipidkugler til ultratynde ark
- Den oppustelige decelerator vil tage en tur på JPSS-2-satellitten
- Facebook udruller privatlivsvalg under EU-regler
- Hvilke pH-numre betragtes som sure, base- og neutrale?
- Hvordan chefer reagerer, har indflydelse på, om arbejderne siger deres mening


