Røntgenlaserforskere udvikler en ny måde at se bakterier angribe antibiotika

Eksperimentet blev udført på Coherent X-ray Imaging (CXI) instrument, der gør brug af den hurtige, strålende røntgenpulser fra Linac kohærente lyskilde. CXI anvender metoden "diffraktion-før-ødelæggelse" til at foretage målinger med ultrakorte røntgenpulser, før de beskadiger deres mål. Kredit:SLAC National Accelerator Laboratory
Tuberkulose, en lungesygdom, der spredes i luften gennem hoste eller nys, dræber nu flere mennesker på verdensplan end noget andet smitsomt middel, ifølge Verdenssundhedsorganisationens seneste globale tuberkuloserapport. Og i hundredtusinder af tilfælde hvert år, behandling mislykkes, fordi de bakterier, der forårsager Tb, er blevet resistente over for antibiotika.
Nu har et internationalt forskerteam fundet en ny måde at undersøge, hvordan Tb-bakterier inaktiverer en vigtig familie af antibiotika:De så processen i aktion for første gang ved hjælp af en røntgenfri-elektronlaser, eller XFEL.
I eksperimenter på Department of Energy's SLAC National Accelerator Laboratory, de blandede et antibiotikum med et enzym kaldet beta-lactamase, som Tb-bakterier bruger, og så derefter i realtid, da enzymet angreb antibiotikummet for at deaktivere det.
Forskernes metode, kaldet mix-and-inject seriel krystallografi, drager fordel af det strålende, ultrahurtige impulser produceret af SLACs Linac Coherent Light Source (LCLS). Røntgenbilleder taget 30 millisekunder til 2 sekunder efter reaktionen begyndte, viste lactamase-binding til antibiotikumet, ceftriaxon, og sprænger en af dens kemiske bindinger.
Resultaterne af forsøget blev offentliggjort i dag i BMC Biologi .
"Denne proof-of-concept undersøgelse viser, at vi er i stand til at se formen og mellemstadierne af molekylerne under processen, "siger Marius Schmidt, en professor i University of Wisconsin Milwaukee, der ledede eksperimentet. "Efter årtiers forsøg med andre teknikker inden for krystallografi, teknologien er her. "
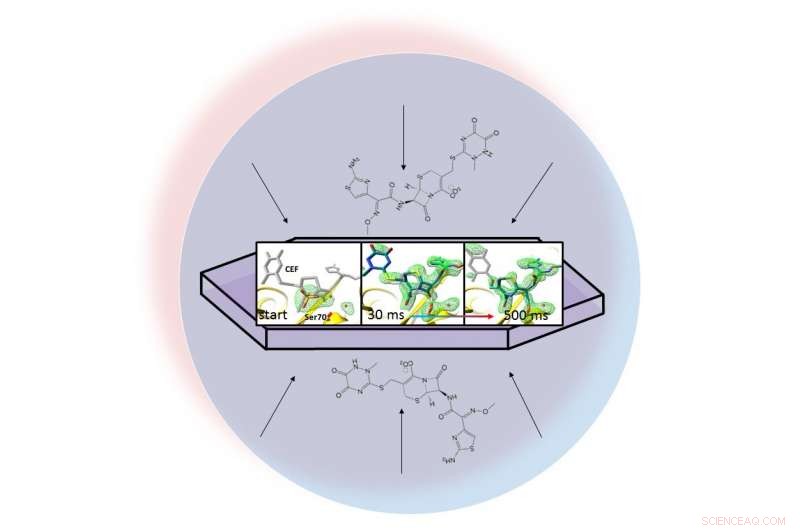
I en væskedråbe (repræsenteret af den lyseblå cirkel), et antibiotikum dispergeres gennem et krystalliseret protein, beta-lactamase, og binder sig til det. Røntgenbilleder af det bundne par tillod forskere at oprette kort over elektrontætheden (grøn) og se en ring i antibiotika bryde op (helt til højre) 30 til 500 millisekunder efter reaktionen begyndte. Kredit:Marius Schmidt / University of Wisconsin Milwaukee
I krystallografi, forskere danner en krystal fra mange kopier af et protein og rammer krystallen med røntgenstråler for at producere et diffraktionsmønster på en detektor, som afslører proteinets atomstruktur. Denne struktur er nøglen til at forstå, hvordan enzymer og andre proteiner fungerer.
Tidligere fungerede dette kun med relativt store krystaller, som har begrænset værdi i denne metode, fordi opløsningen indeholdende antibiotikumet ville tage lang tid at diffundere ind i krystallen og reagere med enzymet. Det er vigtigt, at diffusionen er hurtigere end reaktionen, så de mange proteinmolekyler i krystallen starter den kemiske proces sammen.
Men LCLS og andre XFEL'er har så intense stråler, at de kan fange diffraktionsmønstre fra meget tyndere krystaller, en milliontedel af en meter på tværs eller mindre, Schmidt sagde, så antibiotika hurtigt kan komme til enzymet, og reaktionen kan registreres med røntgenstråler.
"Selvom der har været elegante undersøgelser for at observere proteinbevægelser med lysinducerede ændringer, vores arbejde illustrerer, at en større klasse af proteiner, nemlig enzymer, kan undersøges på en tidsopløst måde ved LCLS og andre XFEL'er, "siger Jose Olmos, en doktorand ved Rice University, som er en af hovedforfatterne til publikationen.
I dette studie, forskergruppen leverede små krystaller af beta-lactamase, mens de blandede dem med antibiotikumet kun brøkdele af et sekund, før de blev ramt med røntgenpulser.
Kredit:CC0 Public Domain
Teamet tog millioner af røntgenbilleder under reaktionen og syede dem sammen for at oprette et kort, der viser ændringer i antibiotikas tredimensionelle struktur, når det interagerer med enzymet ved stuetemperatur.
"For strukturbiologer, sådan lærer vi præcis, hvordan biologi fungerer, "siger Mark Hunter, personaleforsker ved SLAC og medforfatter på undersøgelsen. "Vi tyder et molekyls struktur på et bestemt tidspunkt, og det giver os en bedre idé om, hvordan molekylet fungerer. "
I fremtidige forsøg, at tage endnu flere snapshots i løbet af reaktionen kunne give større detaljer om laktamases struktur og kemiske adfærd. Med mere information kunne forskere manipulere designet af antibiotika for at forhindre sådanne angreb. Den eksperimentelle metode kunne også anvendes til at lære de fine detaljer om andre typer af biologiske processer, hvor enzymer starter eller styrer reaktioner.
"Der bygger en stor spænding på denne metode, fordi det åbner op for denne nye tidsrig for strukturbiologer, "Hunter siger. Tidligere arbejde ved hjælp af denne teknik fangede vending af en RNA" switch, "vigtigt for undersøgelser af retrovira og kræft.
Forskerne planlægger at bruge metoden til at se på yderligere antibiotika. De agter også at drage fordel af højere gentagelseshastigheder-hurtigere affyring af røntgenpulser-forventet ved en fremtidig opgradering til LCLS og ved den nyligt åbnede europæiske XFEL. Dette vil give forskere mulighed for at indsamle de data, de har brug for på få minutter, sammenlignet med dage. De kunne også tage nærbilleder af reaktionerne tættere på hinanden, hvilket kunne give et endnu mere fuldstændigt billede af den hurtige kemi, som det sker.
Sidste artikelRettelse til synkrotronforskningsfejl kan forbedre resultaterne
Næste artikelNy teknologi til enzymdesign
 Varme artikler
Varme artikler
-
 Lighederne mellem stivelse og glycogenNår du tænker på stivelse, tænker du sandsynligvis først på mad, og der er en god grund til det. Mange af dine vigtigste plantemad, som majs og kartofler, er rige på stivelse. Faktisk produceres stive
Lighederne mellem stivelse og glycogenNår du tænker på stivelse, tænker du sandsynligvis først på mad, og der er en god grund til det. Mange af dine vigtigste plantemad, som majs og kartofler, er rige på stivelse. Faktisk produceres stive -
 Let nedbrydning af metal-NHC-komplekser under katalytiske betingelser og nøglerollen for NHC-stabil…Substratformidlet nedbrydning af Pd-NHC-komplekser under katalytiske betingelser. Kredit:Zelinsky Institute of Organic Chemistry Metalkomplekser, der bærer N-heterocykliske carben-ligander (NHC-li
Let nedbrydning af metal-NHC-komplekser under katalytiske betingelser og nøglerollen for NHC-stabil…Substratformidlet nedbrydning af Pd-NHC-komplekser under katalytiske betingelser. Kredit:Zelinsky Institute of Organic Chemistry Metalkomplekser, der bærer N-heterocykliske carben-ligander (NHC-li -
 Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op
Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op -
 Blandeløsninger i verdens mindste reagensglasKredit:University of Manchester Forskere baseret på University of Manchester har demonstreret en ny metode til billeddannelse af levende kemiske reaktioner med atomopløsning ved hjælp af reagensgl
Blandeløsninger i verdens mindste reagensglasKredit:University of Manchester Forskere baseret på University of Manchester har demonstreret en ny metode til billeddannelse af levende kemiske reaktioner med atomopløsning ved hjælp af reagensgl
- To tredjedele af jordens land er på vej til at miste vand, når klimaet opvarmes
- Forskere effektiviserer processen til styring af spindynamik
- Bag disse overskrifter:Tro ikke på påstande, at robotter truer halvdelen af vores job
- Tog en almindelig barnesygdom neandertalerne ned?
- Hvad skaber en relation?
- Forskere identificerer sammenhængen mellem planternes nitrogenoptagelse og reduktion af drivhusgase…


