Designer enzym bruger unaturlig aminosyre til katalyse
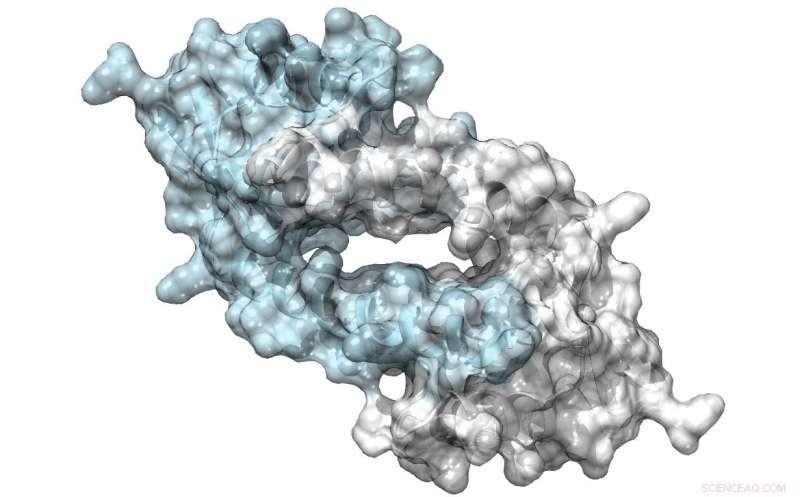
Struktur af LmrR, et protein med en stor pore ved dets dimere grænseflade, som kan binde antibiotika eller rekruttere substrater til at gennemgå katalyse. Kredit:Clemens Mayer / University of Groningen
Kemikere fra University of Groningen har skabt et nyt enzym med en unaturlig aminosyre som sit aktive centrum. De fremstillede enzymet ved at modificere et antibiotisk bindende protein, som normalt fungerer som en bakteriel transkriptionsfaktor. Yderligere modifikationer af det reaktive sted kan skabe forskellige enzymer til brug i kemisk syntese. En beskrivelse af det nye enzym blev offentliggjort i Naturkemi den 2. juli.
Den kemiske industri arbejder hårdt på at erstatte konventionelle processer, som kan bruge giftige kemikalier eller meget energi, med mere miljøvenlige alternativer. Et populært alternativ er enzymer, som normalt fungerer i vand ved moderate temperaturer. Imidlertid, antallet af reaktioner katalyseret af naturlige enzymer er begrænset sammenlignet med, hvad der er tilgængeligt i kemi. "Det er grunden til, at enzymdesign for alvor har taget fart i de seneste år, " siger professor i biomolekylær kemi ved Universitetet i Groningen Gerard Roelfes.
Øget katalyse
Enzymer kan konstrueres på forskellige måder. Endnu, indtil nu, kun de 20 naturligt forekommende aminosyrer er blevet brugt til at skabe det aktive sted for enzymer. Dette begrænser antallet af reaktioner, disse designede enzymer kan udføre, argumenterer Roelfes:"Vi tror, at inkorporering af ikke-standardiserede aminosyrer i proteiner kan udvide repertoiret af designerenzymer betydeligt."
Hans team brugte en bakteriel transkriptionsfaktor som udgangspunkt for deres design. LmrR-proteinet er en transkriptionel regulator i bakterien Lactococcus lactis, som reagerer på antibiotika; det katalyserer ikke kemiske reaktioner af sig selv. Det er en doughnut-formet dimer med en central åbning, der binder hydrofobe molekyler. Ved at bruge udvidede genetiske kodeteknikker, Roelfes og hans kolleger introducerede den unaturlige aminosyre p-aminophenylalanin til proteinet på en sådan måde, at sidekædens anilin var til stede i den centrale åbning. "Anilin er en kendt katalysator i kemisk syntese, men ikke en særlig potent. Introduktion af det til LmrR-proteinet, øget katalyse med næsten tre størrelsesordener."

Proteinstruktur af LmrR poren. Når en unaturlig aminosyre, p-aminophenylalanin, indføres i denne pore, den iboende katalytiske aktivitet af anilinsidekæden (rød struktur) forstærkes med næsten tre størrelsesordener for en model hydrazondannelse. Kredit:Clemens Mayer / University of Groningen
Forskellige reaktioner
Det nye enzym forbinder organiske molekyler ved at danne en hydrazonstruktur, en reaktion, der bruges i medicinsk bioteknologi, for eksempel, at koble lægemidler til antistoffer. "I vores eksperimenter, vi brugte en reaktion, der giver et flot farvet produkt, så vi nemt kunne måle aktiviteten af det nye enzym." Roelfes og hans team ændrer nu den centrale åbning for at øge effektiviteten af enzymet og skræddersy det til specifikke reaktioner.
"Der er mange muligheder for at bruge dette enzymdesign i kemisk syntese, " siger Roelfes "Og vi kunne også introducere andre unaturlige aminosyrer, som har forskellige reaktiviteter." Ved at kombinere disse nye katalytiske egenskaber med det promiskuøse bindingssted for LmrR-proteinet, Roelfes er overbevist om, at der kan skabes mange nye nyttige enzymer.
 Varme artikler
Varme artikler
-
 At Home Science: Naked Egg ExperimentLigesom vores eksperiment med elefanttandpasta er det nakne ægeksperiment en anden klassisk hjemmevidenskabelig aktivitet. Med blot nogle få enkle ingredienser og lidt tålmodighed kan du give dine bør
At Home Science: Naked Egg ExperimentLigesom vores eksperiment med elefanttandpasta er det nakne ægeksperiment en anden klassisk hjemmevidenskabelig aktivitet. Med blot nogle få enkle ingredienser og lidt tålmodighed kan du give dine bør -
 En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo
En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo -
 Hvad er den kemiske formel for Zeolit?Mineralet kendt som zeolit eller zeolit har mange forskellige kemiske elementer i dets sammensætning. Generelt er zeolitter aluminiumsilicatmineraler, der kan transportere vand i deres krystallinsk
Hvad er den kemiske formel for Zeolit?Mineralet kendt som zeolit eller zeolit har mange forskellige kemiske elementer i dets sammensætning. Generelt er zeolitter aluminiumsilicatmineraler, der kan transportere vand i deres krystallinsk -
 Krympefilm får grebKredit:American Chemical Society Mange mennesker husker med glæde at lege med legetøj kendt som Shrinky Dinks - plader af polystyrenplast med former, som børn kan farve, skær ud og varm i en ovn,
Krympefilm får grebKredit:American Chemical Society Mange mennesker husker med glæde at lege med legetøj kendt som Shrinky Dinks - plader af polystyrenplast med former, som børn kan farve, skær ud og varm i en ovn,
- En model til optimering af brugen af lokaltog
- Forskere øger følsomheden af terahertz -gasanalyser væsentligt
- Sådan justeres pH-niveauer
- Det kunne være på tide at begynde at tænke på en kybernetisk Bill of Rights
- Forskeres dybdelæringsalgoritme løser Rubiks Cube hurtigere end noget menneske
- Sådan håndteres en Microscope


