Tankning af MATE-transporteren
Evolutionært konserverede transportproteiner, såsom dem, der tilhører multidrug and toxic compound extrusion (MATE) superfamilien, beskytter celler mod giftige kemikalier og bidrager til multiresistens i kræft- og bakterieceller.
At forstå, hvordan sådanne transportører udnytter energien fra iongradienter for at lette eksport af lægemidler, er afgørende i udviklingen af nye anti-cancer og antibakterielle lægemidler, der kan overvinde resistens.
Rapportering i sidste måned i Proceedings of the National Academy of Sciences , Hassane Mchaourab, PhD, og kolleger brugte DEER (dobbeltelektron-elektronresonans) spektroskopi til at vise, hvordan nogle konserverede aminosyrerester i NorM, en MATE-transportør fra kolerapatogenet, mediere de strukturelle ændringer, der er involveret i lægemiddeludstrømning.
Ved at måle afstande mellem spin-etiketter i NorM, de fandt ud af, at et netværk af rester i det N-terminale domæne er kritisk for ionafhængige konformationelle ændringer, mens rester i det C-terminale domæne medierer lægemiddelbinding.
Deres arbejde illustrerer også, hvordan natriumioner og protoner driver den konformationelle cyklus til at drive transportmekanismen.
 Varme artikler
Varme artikler
-
 Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy
Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy -
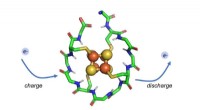 Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor -
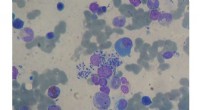 Shagene En syntese perfektioneret til behandling af leishmaniasisKnoglemarvsaspiration:Leishmaniasis (Leishmania sp.) Hos levertransplanteret modtager. Kredit:Paulo Henrique Orlandi Mourao, CC BY-SA 3.0 Lige nord for Antarktis og lidt øst for sydspidsen af Sy
Shagene En syntese perfektioneret til behandling af leishmaniasisKnoglemarvsaspiration:Leishmaniasis (Leishmania sp.) Hos levertransplanteret modtager. Kredit:Paulo Henrique Orlandi Mourao, CC BY-SA 3.0 Lige nord for Antarktis og lidt øst for sydspidsen af Sy -
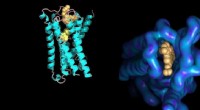 Måling af molekylære interaktionerMolekylær model af en proteinmembranreceptor bundet til dens små molekyle ligander med strukturelle detaljer af det allosteriske bindingssted (til højre). Kredit:Ilaria Piazza / ETH Zürich / PDB datab
Måling af molekylære interaktionerMolekylær model af en proteinmembranreceptor bundet til dens små molekyle ligander med strukturelle detaljer af det allosteriske bindingssted (til højre). Kredit:Ilaria Piazza / ETH Zürich / PDB datab


