Computersimulering af receptorer afslører et nyt ligandbindingssted
Ved hjælp af en computersimulering af en vigtig receptor, EPFL -forskere har opdaget et nyt bindingssted for naturlige ligander og lægemidler. Det nye sted kan være til stede på andre receptorer og kan udnyttes i nye behandlinger for flere sygdomme.
De fleste biologiske processer i en celle går gennem receptorer. Disse er specialiserede proteiner, der aktiveres, når en ligand binder til dem. Ligander kan være alle slags molekyler (f.eks. Hormoner, nukleinsyrer, neurotransmittere osv.), og ved at binde receptorer - og andre proteiner - kører de komplekse processer såsom cellevedligeholdelse, immunrespons, genetik og andre.
Disse normale celleprocesser involverer komplekse "dominoer" af biokemiske signaler, der transporteres på tværs af cellen gennem protein-ligand-interaktioner. På den anden side, de ligger også i kernen i et stort antal sygdomme. En hel forskningsgren kendt som "receptorfarmakologi" er dedikeret til at udnytte disse interaktioner med syntetiske ligander (lægemidler), forsøger at finde ligandbindende steder, der kan udnyttes som et lægemiddelmål.
Nu, forskere under ledelse af professor Horst Vogel ved EPFL har udviklet en computersimulering af den udbredte muskarine acetylcholinreceptor. Specifikt, forskerne undersøgte receptorens undertyper M3 og M4, som hovedsageligt er involveret i lungernes funktion (M3) og centralnervesystemet (M3 og M4).
Receptorerne tilhører den store familie af såkaldte "G-proteinkoblede receptorer" (GPCR'er), som generelt registrerer signaler, der kommer udefra cellerne, såsom lys, hormoner, eller neurotransmittere. Ved aktivering, GPCR'er ændrer deres struktur på en sådan måde, at de kan binde og aktivere andre proteiner inde i cellen og i sidste ende tænde den passende proces.
GPCR'er er målet for mere end en tredjedel af moderne terapeutiske forbindelser, hvilket betyder, at det at finde nye ligandbindingssteder kan hjælpe med at designe mere effektive GPCR-målrettede lægemidler.
Teamet brugte det, der er kendt som "molekylær dynamiksimuleringer", som er en metode til simulering af at studere de fysiske bevægelser af atomer og molekyler i en computer. Metoden kan afsløre detaljer ned til niveauet for individuelle atomer, og dermed tilbyde en måde i høj opløsning at se på, hvordan forskellige ligander binder sig til receptoren-og, vigtigere, hvor.
Undersøgelsen afslørede et nyt bindingssted på acetylcholinreceptorerne, som kan udnyttes farmakologisk til at forstå ligandbinding og aktiveringsprocesser. Når en ligand binder sig til det nye sted, det får hele webstedet til at udvide sig. Stedet ser ud til at være i stand til at binde små ligander og forårsage forskellige virkninger på receptoren, end den "vigtigste" ligand ville.
Ser man på mere end 200 ligandbundne GPCR-strukturer, forskerne opdagede, at de fleste ligander binder de traditionelle ("orthosteriske") steder på receptorerne. Imidlertid, en receptor, der binder leukotrien (LTB4) og leder immunceller til infektionssteder syntes at binde en "dobbelt" ligand, som binder det nye sted opdaget i de to acetylcholinreceptorer. Det nye sted blev opdaget i mange andre af de over 200 receptorer, som forskerne undersøgte.
Undersøgelsen viser, at det nye bindingssted kan eksistere i andre GPCR'er, åbner en ny mulighed for opdagelse af GPCR -lægemidler. "Undersøgelsen viser kraften i beregningsmetoder til at løse atomare detaljer centrale receptor-medierede signalreaktioner, "siger Horst Vogel." Det udfordrende næste trin er at bruge beregningsmetoder til at designe nye forbindelser, der ville passe ind i de nyligt fundne bindingssteder for at aktivere eller deaktivere receptoren i en defineret tilstand og dermed designe nye lægemidler. "
 Varme artikler
Varme artikler
-
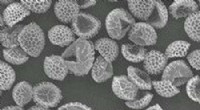 Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll
Rengøring af forurenende stoffer fra vand med pollen og sporer - uden achoo!De fyldte overflader af behandlede sporkorn, her vist forstørret cirka 300 gange, kan fjerne uønskede kemikalier fra forurenet vand. Kredit:Andrew Boa og Aimilia Meichanetzoglou Ud over deres roll -
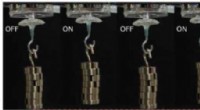 Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G
Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G -
 Fysiske og kemiske egenskaber ved natriumbicarbonatEn almindelig hæfteklamme i mange hjem og videnskabslokaler er natriumbicarbonat almindeligvis kendt under navnet bagepulver. Ligesom alle slags stoffer har natriumbicarbonat endelige fysiske og kemis
Fysiske og kemiske egenskaber ved natriumbicarbonatEn almindelig hæfteklamme i mange hjem og videnskabslokaler er natriumbicarbonat almindeligvis kendt under navnet bagepulver. Ligesom alle slags stoffer har natriumbicarbonat endelige fysiske og kemis -
 Spilde bønnerne på kaffens sande identitetKredit:Pixabay/CC0 Public Domain Folk verden over ønsker, at deres kaffe både er tilfredsstillende og til en rimelig pris. For at opfylde disse standarder, ristemaskiner bruger typisk en blanding
Spilde bønnerne på kaffens sande identitetKredit:Pixabay/CC0 Public Domain Folk verden over ønsker, at deres kaffe både er tilfredsstillende og til en rimelig pris. For at opfylde disse standarder, ristemaskiner bruger typisk en blanding
- CXOGBS J175553.2-281633 er en kataklysmisk variabel, undersøgelse finder
- Klimamysterier forvirrer stadig videnskabsmænd, trods fremskridt
- Ny amerikansk plan for autonome køretøjer lader industrien regulere sig selv
- Video:Matthias Maurer:træning til en rumvandring
- Forskere pirrer det unikke kemiske fingeraftryk af de mest aggressive frie radikaler i levende ting
- Ioniserede molekyler sporer galaktiske udstrømninger


