Fleksibel, stabil og potent mod kræft - ny tilgang til tumorbehandling
Kredit:Angewandte Chemie
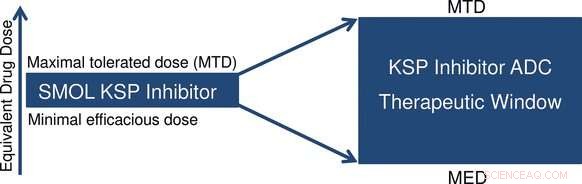
At koble terapeutisk aktive molekyler til specifikke antistoffer kan hjælpe med at pilotere dem til deres udpegede mål og minimere bivirkninger - især ved behandling af tumorer. I journalen Angewandte Chemie , forskere har nu beskrevet nye konjugater fremstillet af antistoffer og en kinesinspindelproteinhæmmer. Ændring af linker mellem de to komponenter muliggør indstilling af aktiviteten af dette cytostatiske lægemiddel, som er effektiv mod en bred palet af kræftformer.
Medicin skal være yderst effektiv, men relativt fri for bivirkninger. Dette er især vigtigt i kræftbehandling, fordi de anvendte cytostatika forstyrrer reguleringsmekanismerne for alle celler i kroppen, forårsager symptomer som nedsat immunforsvar, hårtab, og kvalme. Behandlinger har derfor til formål at indføre cytostatika direkte i tumorceller, før de udløser deres toksiske virkning. En af måderne til at opnå dette er at vedhæfte sådanne små lægemiddelmolekyler til et antistof for at lave et konjugat. Brokomponenten, kaldet linkeren, skal holde konjugatet sammen, så længe det cirkulerer i blodet. Antistoffet binder specifikt til bindingssteder (antigener), der er særligt talrige på overfladerne af målrettede tumorceller. Docking af antistoffet udløser optagelse af konjugatet inde i kræftcellerne. Der, stoffet frigives af enzymer til at udføre sin destruktive opgave specifikt på kræftcellen. Sunde celler forbliver stort set uberørte.
Antallet af cytostatika, der med succes er blevet inkorporeret i sådanne antistofkonjugater, har hidtil været begrænset. Forskere under ledelse af Hans-Georg Lerchen (Bayer AG) har nu forsøgt dette med et cytotoksin, der bruger en anden mekanisme end klassiske cytostatika til at angribe cellecyklussen. Det er en ny pyrrolbaseret kinesinspindelprotein (KSP) -hæmmer. KSP spiller en central rolle i centrosomseparation under celledeling. Blokering af dette trin forårsager en stærk antitumor -effekt. Selv meget lave doser af inhibitoren var yderst effektive mod en bred palet af kræftcellelinjer. Lerchen og hans kolleger har demonstreret, at denne teknik kan bruges til at lave meget aktive antistofkonjugater. Brug af forskellige antistoffer giver dem mulighed for at målrette mod en række forskellige typer tumorer.
Forskerne var i stand til at forbinde inhibitoren på en række forskellige fastgørelsespunkter ved hjælp af stabile linkere til antistoffet og derved forhindre for tidlig spaltning. Kun inde i tumorcellerne, konjugaterne metaboliseres af enzymer, frigørelse af inhibitoren. Variation af linker giver mulighed for kontrolleret variation af de resulterende inhibitormolekyler, så deres aktivitet kan skræddersys til specifikke krav. Hæmmere, der ikke kan udvises fra cellerne, ophobes i tumorcellerne, forlænge deres aktive periode. Hæmmere, der kan udvises, kan komme ind i nabotumorceller, som især er nyttig til behandling af tumorer, der indeholder et heterogent mønster af antistofbindingssteder.
De nye konjugater er yderst effektive in vitro og viste sig at være effektive i tumormodeller til forskellige indikationer in vivo. I forsøg med mus førte de til fuldstændig remission af en humant blæretumormodel - med minimale bivirkninger.
 Varme artikler
Varme artikler
-
 Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor
Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor -
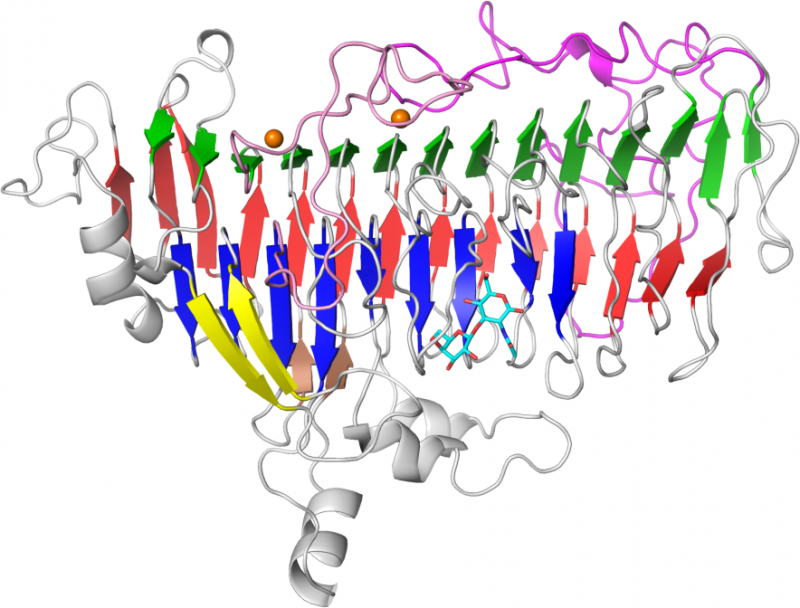 Hvordan en gavnlig tarmmikrobe tilpasser sig modermælkMolekylær struktur af lacto-N-biosidase LnbX, et enzym fra en symbiotisk bakterie (B. longum) i spædbørns tarm til at nedbryde sukker i modermælken. Kredit:Yamada og Gotoh et al. Modermælk giver v
Hvordan en gavnlig tarmmikrobe tilpasser sig modermælkMolekylær struktur af lacto-N-biosidase LnbX, et enzym fra en symbiotisk bakterie (B. longum) i spædbørns tarm til at nedbryde sukker i modermælken. Kredit:Yamada og Gotoh et al. Modermælk giver v -
 Kigger ind i batterier:Røntgenstråler afslører lithium-ion-mysterierArgonne-fysiker Mahalingam Balasubramanian indlæser et lithium-ion-batteri in situ i det uelastiske røntgensystem med lav energiopløsning (LERIX) ved Advanced Photon Source. Kredit:Argonne National La
Kigger ind i batterier:Røntgenstråler afslører lithium-ion-mysterierArgonne-fysiker Mahalingam Balasubramanian indlæser et lithium-ion-batteri in situ i det uelastiske røntgensystem med lav energiopløsning (LERIX) ved Advanced Photon Source. Kredit:Argonne National La -
 Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord
Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord
- Den rigtige blanding af grøn energi
- Ny software har til formål at gøre videnskaben mere replikerbar
- Oklahomas Environmental Problems
- Indias mest folkerige stat forbyder plast, endnu engang
- Abiotiske faktorer i et ørkenøkosystem
- Seattle-baseret isbryder vil gøre Northwest Passage transit i ny arktisk mission


