3-D dyrkning af hepatocytter på en lever-på-en-chip-enhed
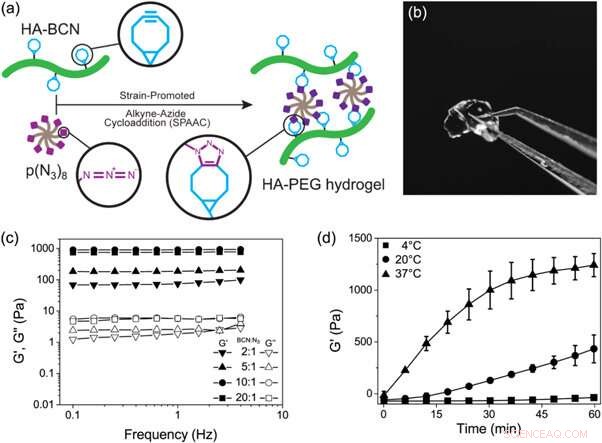
(a) Skematisk repræsentation af dannelsen af HA-PEG-hydrogeler gennem en stamme-promoveret alkyn-azid-cycloadditionsreaktion. (b) Fotografi af en HA-PEG hydrogel efter dannelse. (c) Frekvenssweep af HA-PEG-hydrogeler med forskellige BCN til N3-forhold. (d) Geleringstidseksperiment, der viser stigningen af G' over tid under gelering af HA-PEG hydrogeler (10:1 BCN:N3) ved forskellige temperaturer. Kredit: Biofremstilling , doi:https://doi.org/10.1088/1758-5090/aaf657
Lever-på-en-chip cellekulturenheder er attraktive biomimetiske modeller i lægemiddelopdagelse, toksikologi og vævsteknisk forskning. For at opretholde specifikke levercellefunktioner på en chip i laboratoriet, passende celletyper og dyrkningsbetingelser skal være opfyldt, som omfatter 3D-celleorientering og en konsekvent forsyning af næringsstoffer og ilt. Sammenlignet med konventionelle 2D-cellekulturteknikker, organ-på-en-chip-enheder tilbyder alsidighed og effektiv biomimik velegnet til avancerede anvendelser inden for lægemiddelopdagelse og medicin.
I en nylig undersøgelse offentliggjort på Biofremstilling , Jonas Christoffersson og kolleger demonstrerede, hvordan hydrogeler, der efterligner den ekstracellulære matrix, kan understøtte funktionaliteten og levedygtigheden af hepatocytter i en perfunderet lever-på-en-chip-enhed. De tværfaglige forskere i afdelingen for bioteknologi og molekylær fysik konstruerede et hydrogelsystem baseret på hyaluronan og poly(ethylenglycol) (HA-PEG) polymerer. De udviklede hydrogelerne ved hjælp af klikkemi. For at aktivere processen, forskerne gennemførte en biorthogonal reaktion (kemi, der forekommer i levende systemer uden indblanding af native biokemiske reaktioner) mellem en cyclooctyndel og alkynazid-mærket reaktionspartner, kendt som stamme-promoveret alkynazid cycloaddition (SPAAC).
De nye hydrogelmaterialer blev konstrueret og karakteriseret i sammenligning med eksisterende agarose- og alginathydrogeler for cellekompatibilitet (cytokompatibilitet). Til biofunktionaliseringsundersøgelser, forskerne brugte humane inducerede-pluripotente stamcelle-afledte hepatocytter (hiPS-HEP'er). For at forbedre overfladecytokompatibiliteten af biomaterialet, HA-PEG-hydrogeler blev ændret med azid-modificerede celleadhæsionsmotiver for at lette effektive cellemateriale-vedhæftninger. I det overfladefunktionaliserede biomateriale, hepatocytstamcellerne migrerede og voksede i 3D-retninger, med øget levedygtighed. Forskerne observerede højere albuminproduktion på det nye materiale (karakteristisk leverprotein), sammenlignet med celler dyrket på andre hydrogeler. Den fleksible, SPAAC tværbundet hydrogelsystem med perfunderet 3D-cellekultur af hiPS-HEP'er er et lovende materiale til at optimere lever-på-en-chip-enheder.
Miniaturiserede bioreaktorer kendt som 'organ-på-chips', er for nylig dukket op som alternative cellekulturmodeller, der bedre efterligner det in vivo biologiske mikromiljø i laboratoriet. Leveren er en model af særlig interesse i medicinsk forskning på grund af lægemiddelhepatotoksicitet observeret i alle faser af klinisk lægemiddeludvikling. Tidligere publikationer beskriver brugen af organ-on-chips til at forudsige resultatet af et lægemiddels indvirkning i kliniske forsøg og evaluere lægemiddelinteraktioner med hepatocytter i laboratoriet.
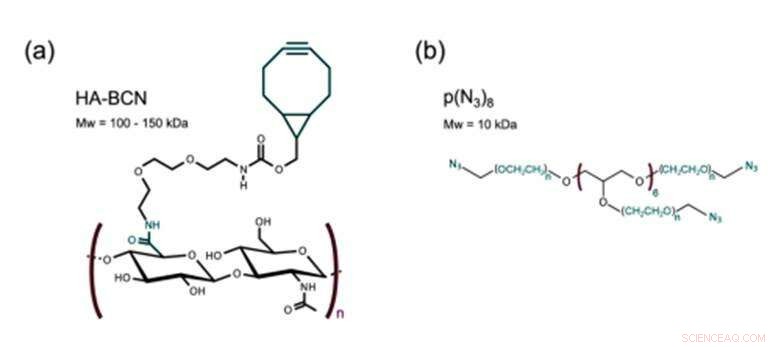
Struktur af a) HA-BCN med et forhold n/m på 0,19 og b) p(N3)8. Kredit: Biofremstilling , doi:https://doi.org/10.1088/1758-5090/aaf657
På grund af deres bredere vedtagelse i akademiske og industrielle omgivelser, bioreaktorerne kræver optimerede materialer og betingelser for fremstilling med høj kapacitet. Betingelser omfatter udskiftning af det almindelige prototypemateriale polydimethylsiloxan (PDMS), integration af inducerede pluripotente stamceller (iPSC)-afledte celler på et blødt biomateriale, der letter deres vækst og minimerer det store dødvolumen forårsaget af mikrofluidiske reservoirer og slanger fra organ-on-chips-enheder.
Det nye biomateriale fremstillet i undersøgelsen indeholdt to hovedbestanddele tværbundet via SPAAC; en cykloocyt-modificeret hyaluronan (HA-BCN) og en multiarmet azid-modificeret PEG [p(N) 3 ) 8 ]. BCN reagerede med azider (N 3 ) på den 8-armede PEG-polymer med afsluttende N 3 -dele til at danne en stabil 1, 2, 3-triazol. Christoffersson et al. fuldførte kemiske reaktioner under fysiologiske betingelser for at danne hydrogelerne med justerbare viskoelastiske egenskaber. Tværbindingsstrategien var ideel til at fremstille hydrogeler til 3D-cellekultur; da cellerne kunne indkapsles i biomaterialet uden at kompromittere deres levedygtighed og var egnede til brug i mikrofluidiske enheder. Forskerne brugte overskydende SPAAC-dele på det nye biomateriale til at vedhæfte forskellige ligander inklusive RGD-peptider for at fremme interaktioner ved celle-materiale-grænsefladen.
Derefter, forskerne varierede sammensætningen af de to hovedbestanddele for at forstå de resulterende viskoelastiske egenskaber, såsom lagringsmodulet (G') og tabsmodulet (G") af hydrogelerne via oscillerende rheologi (teknik til at måle den viskoelastiske opførsel af bløde materialer). De kontrollerede geldannelseskinetikken af den nye hydrogel ved stigende temperaturer. Geleringskinetik af det nye biomateriale var langsomt nok til homogen cellefordeling, men hurtigt nok til at forhindre cellesedimentering. Evnen til at kontrollere geldannelseskinetik gjorde det muligt for forskerne at overveje en række biofremstillingsstrategier (f.eks. bioprint) og hydrogelsamling inden for de mikrofluidiske systemer til organ-på- chip applikationer.
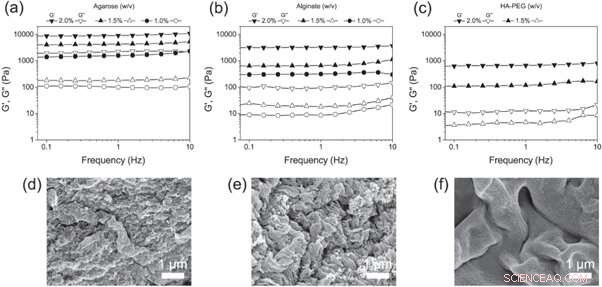
(a)–(c) Frekvenssweep af (a) agarose, (b) alginat og (c) HA-PEG hydrogeler i forskellige koncentrationer. (d)–(f) SEM mikrofotografier af (d) agarose, (e) alginat og (f) HA-PEG hydrogeler, der viser morfologien af hver hydrogel. Kredit: Biofremstilling , doi:https://doi.org/10.1088/1758-5090/aaf657
Christoffersson et al. derefter sammenlignede HA-PEG hydrogelerne med de veletablerede 3D cellekultur stilladser - agarose og alginat hydrogeler. For at bestemme de endelige viskoelastiske egenskaber egnet til 3D-cellekultureksperimenter, de brugte oscillerende rheologi til at undersøge de forskellige polymerkoncentrationer. Forskerne analyserede sammensætningen af de færdige materialer ved hjælp af scanning elektronmikroskopi (SEM) billeder.
Lever-på-en-chip design og opsætning skulle opfylde to nøglekriterier i undersøgelsen:
1. Tillad perfusion (passage af væske) af cellekulturmedium hen over hydrogeloverfladen for stabil udveksling af næringsmedier, til og fra de indkapslede hepatocytter.
2. Tillad prøveudtagning af det perfunderede medium til eksperimentel analyse under igangværende cellekultur, uden at påvirke hepatocytterne og hydrogelen.
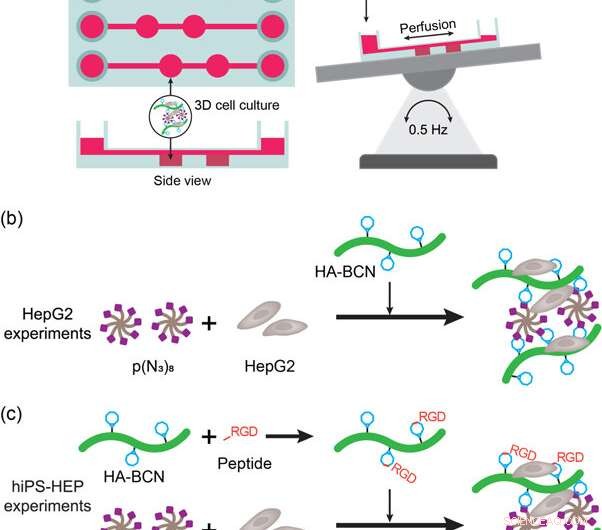
(a) Skematisk repræsentation af lever-på-en-chip-enheden og opsætningen. Enheden blev sat på et automatisk vippebord for at tillade perfusion af medier og næringsstoffer under cellekultur. (b) Afbildning af HepG2 3D cellekultureksperimenter med HA-PEG hydrogeler. HepG2-cellerne blev tilsat til mediesuspenderet p(N3)8 forud for tilsætning af HA-BCN. (c) Skildring af hiPS-HEP 3D-cellekultureksperimenterne med HA-PEG-hydrogeler. HiPS-HEP-cellerne blev tilsat til mediesuspenderet p(N3)8 forud for tilsætning af HA-BCN. I forsøg med enten linRGD- eller cRGD-peptid, HA-BCN blev præinkuberet med 1 μM af tilsvarende peptid i 1 time før tilsætning af HA-BCN(RGD)-komponenten til hiPS-HEP/p(N3)8-blandingen. Kredit: Biofremstilling , doi:https://doi.org/10.1088/1758-5090/aaf657
For at opfylde disse kriterier, forskerne brugte en kommerciel 3D -cellekulturanordning (μ -Slide III 3D Perfusion IbiTreat) indeholdende to på hinanden følgende kamre (2 x 30 µL) i tre parallelle arrays - hver forbundet til mediereservoirer for at perfundere væske. For effektiv perfusion, de monterede enheden på et automatisk gyngebord ved at vende perfusatretningen hen over de hydrogelholdige kamre. Den eksperimentelle opsætning tillod perfusion gennem enheden, opfylder de første kriterier. For at opfylde det andet kriterium, de lokaliserede vægge ved siden af hydrogelkamrene gjorde det muligt for forskerne at prøve perfusatet uden at forstyrre hydrogelen eller cellebestanddelene.
Forskerne undersøgte først biofunktionalisering af lever-på-en-chip-enheder i undersøgelsen med HEPG2-celler (levercarcinomcellelinje) indkapslet i hydrogeler, efter 3, 7 og 9 dages cellekultur. De sammenlignede cellemorfologien, levedygtighed og funktionalitet med agarose- og alginat -hydrogeler. Undersøgelsen omfattede levende/døde assays for at bekræfte cellelevedygtighed og yderligere bekræftet HepG2-funktionalitet ved at detektere albumin- og urinstofsekretioner i supernatanten af cellekulturen.
For forbedret cellefunktionalitet (overfladefastgørelse og mobilitet på materialer), forskerne podede celleadhæsionsmotiver såsom lineære eller cykliske RGD-peptider (lineær linRGD eller cyklisk cRGD) på hydrogelerne. I dette tilfælde, hiPS-HEP-celler (hepatocytstamceller) blev dyrket på tværs af forskellige hydrogel-sammensætninger i 13 dage for at undersøge morfologi og levedygtighed (levende/død farvning) efter celle-materiale-interaktioner. Forskerne brugte seks forskellige hydrogelbaserede biomaterialeoverflader i eksperimenterne, herunder; 2D (HEP coat), Agarose, Alginat, HA-PEG, HA-PEG (linRGD) og HA-PEG (cRGD).
HiPS-HEP-cellerne indkapslet og dyrket i den modificerede hydrogel voksede inden for 2D og ægte 3D-konstruktioner. For at teste funktionaliteten af de dyrkede hiPS-HEP-celler (stamceller), forskerne kvantificerede deres albumin- og urinstofudskillelse. Resultaterne viste, at kun supernatanterne af stamceller dyrket i 2D-overflader og i nærvær af cRGD-motivet udskilte hydrogeler albumin.
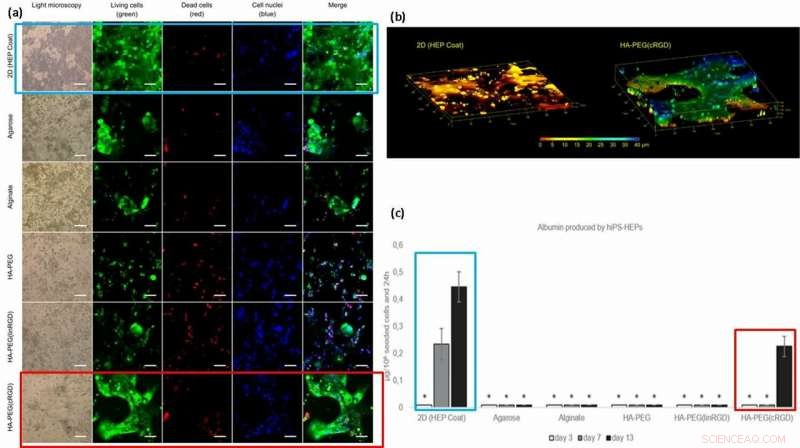
(a) Levedygtighed og morfologi af hiPS-HEP-celler efter 13 dages dyrkning. Cellelevedygtighed synes at være afhængig af cellens evne til at binde sig til overfladen, hydrogelen, eller til hinanden. Store strukturer af hiPS-HEP'er blev dannet i HA-PEG (cRGD). (calcein, grøn), døde celler (ethidium homodimer-1, rød), og kerner (Hoechst 33 342, blå). (b) Z-stak af billeder opnået ved konfokal mikroskopi afslører den flade form af hiPS-HEPS, når den dyrkes på et 2D-substrat (venstre) sammenlignet med 3D-konstruktionerne af cellerne i en HA-PEG(cRGD) hydrogel (højre). Farverne repræsenterer højden over 3D-cellekulturenhedens kammerbund, dvs. Z-aksen, fra 0 μm (rød) til 40 μm (blå). (c) Albumin produceret af hiPS-HEP på HEP Coat i 2D og i de forskellige hydrogeler. * angiver, at albuminkoncentrationsniveauerne var for lave til pålidelig kvantificering. Kredit: Biofremstilling , doi:https://doi.org/10.1088/1758-5090/aaf657
Baseret på resultaterne, forskerne tilskrev den højere albumin-mængde på 2D HEP-belægningen til hastigheden af albumin-diffusion i hydrogeler; overførsel på tværs af 2D-belægning er hurtigere end 3D. Den højere koncentration af albumin med cRGD-motiv bundne hydrogeler, korreleret med den øgede cellevækst og levedygtighed observeret på de cRGD-bundne biomaterialeoverflader. Som resultat, forskerne har til hensigt at bruge cykliske former for RGD-peptid til at hjælpe med hepatocytstamcellekultur på hydrogeler, der er forberedt til lever-på-en-chip-enheder i fremtiden.
På denne måde undersøgelsen detaljerede fordelene ved at bruge hyaluronan-PEG-baseret hydrogel modificeret med RGD-peptider til 3D-kulturer af hepatocytter (cirka 13 dage) i en lever-på-en-chip-opsætning. Som benchmarks for undersøgelsen, Christofferfsson og kolleger brugte de almindeligt tilgængelige alginat- og agarosehydrogeler. I fremtiden, forskerne vil optimere de viskoelastiske egenskaber og koncentrationen af celleadhæsionsmotiver på HA-PEG hydrogelsystemet til biomimetisk cytokompatibilitet. The optimized hydrogel system can be combined with the device setup to facilitate physiologically relevant liver-on-a-chip platforms for clinical research in drug toxicology, drug discovery and regenerative medicine.
© 2019 Science X Network
Sidste artikelNy skala for elektronegativitet omskriver lærebogen i kemi
Næste artikelNyt lys kastede over intenst studeret materiale
 Varme artikler
Varme artikler
-
 Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets
Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets -
 Banebrydende undersøgelse af cellesignalering lover for immunforskning og videreDen atomare struktur af SOS-proteinet, et cellemeddelelsesmolekyle, der bruger en unik timingmekanisme til at regulere aktiveringen af en kritisk immunsystemvej. Kredit:Steven Alvarez/Berkeley Lab
Banebrydende undersøgelse af cellesignalering lover for immunforskning og videreDen atomare struktur af SOS-proteinet, et cellemeddelelsesmolekyle, der bruger en unik timingmekanisme til at regulere aktiveringen af en kritisk immunsystemvej. Kredit:Steven Alvarez/Berkeley Lab -
 Forskere demonstrerer, hvordan man forbedrer stålegenskaberI Laboratoriet for højintensiv ionimplantation. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har opdateret legeringsprocessen, dvs. at forbedre egenskaberne af m
Forskere demonstrerer, hvordan man forbedrer stålegenskaberI Laboratoriet for højintensiv ionimplantation. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har opdateret legeringsprocessen, dvs. at forbedre egenskaberne af m -
 Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
- Hvad skete der med vores lovede fritid? Og finder vi det i den smarte by?
- Sådan bruges tællere i matematik
- Fysikere demonstrerer eksistensen af en ny subatomær struktur
- En ny type brand, fremtidens brændstof?
- Ny metode designer nanomaterialer med mindre end 10 nanometer præcision
- Et skridt i retning af at gøre GPS mere modstandsdygtig over for rumvejr


