Ny skala for elektronegativitet omskriver lærebogen i kemi

Elektronegativitet omdefineret:En ny skala for elektronegativitet dækker de første 96 elementer, en markant stigning i forhold til tidligere versioner. Kredit:Martin Rahm/Chalmers Tekniske Universitet
Elektronegativitet er en af de mest kendte modeller til at forklare, hvorfor kemiske reaktioner opstår. Nu, Martin Rahm fra Chalmers Tekniske Universitet, Sverige, har omdefineret konceptet med en ny, mere omfattende skala. Hans arbejde, gennemført med kolleger, herunder en nobelprisvinder, er blevet offentliggjort i Journal of the American Chemical Society .
Teorien om elektronegativitet bruges til at beskrive, hvor stærkt forskellige atomer tiltrækker elektroner. Ved at bruge elektronegativitetsskalaer, man kan forudsige den omtrentlige ladningsfordeling i forskellige molekyler og materialer, uden at skulle ty til komplekse kvantemekaniske beregninger eller spektroskopiske undersøgelser. Dette er afgørende for at forstå alle slags materialer, samt til at designe nye. Brugt dagligt af kemikere og materialeforskere over hele verden, konceptet stammer fra den svenske kemiker Jöns Jacob Berzelius' forskning i det 19. århundrede og undervises bredt på gymnasieniveau.
Nu, Martin Rahm, Adjunkt i fysisk kemi ved Chalmers Tekniske Universitet, har udviklet en helt ny skala for elektronegativitet.
"Den nye definition er den gennemsnitlige bindingsenergi af de yderste og svageste bundne elektroner - almindeligvis kendt som valenselektronerne, " forklarer han.
"Vi udledte disse værdier ved at kombinere eksperimentelle fotoioniseringsdata med kvantemekaniske beregninger. de fleste elementer relaterer sig til hinanden på samme måde som i tidligere skalaer. Men den nye definition har også ført til nogle interessante ændringer, hvor atomer har skiftet plads i rækkefølgen af elektronegativitet. Derudover for nogle grundstoffer er det første gang, deres elektronegativitet er blevet beregnet."
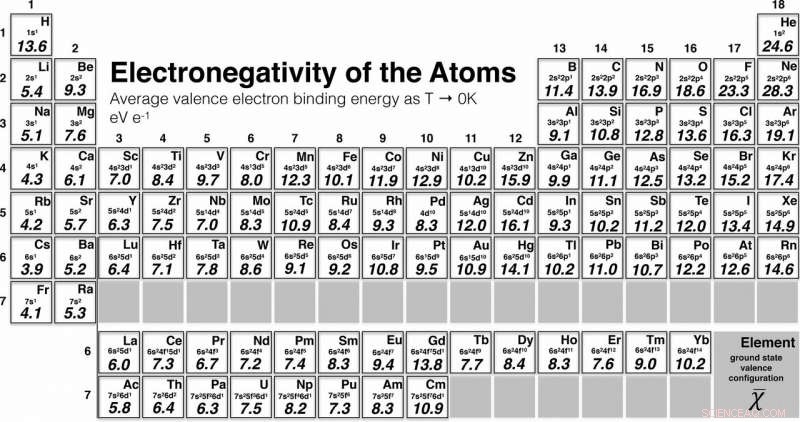
Periodisk system, der viser værdierne af de første 96 grundstoffer i den nye skala for elektronegativitet, offentliggjort i artiklen i Journal of the American Chemical Society . Kredit:Martin Rahm/Chalmers Tekniske Universitet
For eksempel, sammenlignet med tidligere skalaer, oxygen og krom er begge blevet flyttet i ranglisten, i forhold til grundstoffer tættest på dem i det periodiske system. Den nye skala omfatter 96 elementer, en markant stigning i forhold til tidligere versioner. Skalaen løber nu fra det første element, brint, til den seksoghalvfems, curium.
En motivation for forskerne til at udvikle den nye skala var, at selvom der findes flere forskellige definitioner af begrebet, hver er kun i stand til at dække dele af det periodiske system. En yderligere udfordring for kemikere er, hvordan man forklarer, hvorfor elektronegativitet nogle gange ikke er i stand til at forudsige kemisk reaktivitet eller polariteten af kemiske bindinger.
En yderligere fordel ved den nye definition er, hvordan den passer ind i en bredere ramme, der kan hjælpe med at forklare, hvad der sker, når kemiske reaktioner ikke styres af elektronegativitet. I disse reaktioner, som kan være svært at forstå ved brug af konventionelle kemiske modeller, komplekse interaktioner mellem elektroner er på arbejde. Det, der i sidste ende bestemmer udfaldet af de fleste kemiske reaktioner, er ændringen i den samlede energi. I det nye blad, forskerne tilbyder en ligning, hvor den samlede energi af et atom kan beskrives som summen af to værdier. Den ene er elektronegativitet, og den anden er den gennemsnitlige elektroninteraktion. Størrelsen og karakteren af disse værdier, når de ændrer sig i løbet af en reaktion, afslører den relative betydning af elektronegativitet for at påvirke den kemiske proces.
Der er uendelige måder at kombinere atomerne i det periodiske system for at skabe nye materialer. Elektronegativitet giver en første vigtig indikator for, hvad der kan forventes af disse kombinationer.
"Skalaen er omfattende, og jeg håber, at det i høj grad vil påvirke forskningen i kemi og materialevidenskab. Elektronegativitet bruges rutinemæssigt i kemisk forskning og med vores nye skala kan en række komplicerede kvantemekaniske beregninger undgås. Den nye definition af elektronegativitet kan også være nyttig til at analysere elektroniske strukturer beregnet gennem kvantemekanik, ved at gøre sådanne resultater mere forståelige, siger Martin Rahm.
 Varme artikler
Varme artikler
-
 Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor
Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor -
 Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer
Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer -
 Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m
Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m -
 Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d
Høj opløsning, terahertz-drevet atomprobe tomografiIonfeltfordampning udløst af terahertz i en tomografisk atomprobe. (A) Ultrashort terahertz (røde) pulser er fokuseret på en metallisk nanotip inde i et højvakuumkammer. Den højspænding, der påføres d
- Politisk polariserede teams producerer bedre arbejde, analyse af Wikipedia-fund
- Klimaændringer påvirker skrøbelige flodøkosystemer
- Forskere opdager en af de mest lysende nye stjerner nogensinde
- Ændring af administrerende direktør før børsnotering kan hæve værdiansættelsen
- GRID3-projektet har til formål at sætte alle på kortet
- Kan stærkt linsede type Ia supernovaer løse en af kosmologiens største kontroverser?


