Salt smelter ikke is - her er hvordan det faktisk gør vintergader sikre

Sprøjtning af salt på veje er en sikkerhedsforanstaltning. Kredit:stoatphoto/Shutterstock.com
Brrr ... det er koldt derude! Børn strømmer til fjernsynet i håb om at høre, at der kommer en snedag; brød- og mælkegangene i købmandsforretninger er tomme på grund af en forestående snestorm; og nyttebiler er ude og sprøjte salt eller saltvand på vejene.
Vi ved alle, hvorfor de to første sker - børn er spændte på en dag fri fra skolen fyldt med varm chokolade og snemænd. Voksne fylder på med nødvendigheder. Men hvad er der med de lastbiler?
De arbejder på at beskytte chaufførerne mod glatte forhold ved at sprøjte stensalt eller en opløsning af saltvand for at forhindre isdannelse. Dette salt ligner meget det salt, du har på dit spisebord - det er det samme natriumchlorid, NaCl. Der er nogle proprietære blandinger, der indeholder andre salte - såsom kaliumchlorid (KCl) og magnesiumchlorid (MgCl) - men de er ikke så almindeligt anvendte.
Vejsalt er ikke så rent som det, du bruger på din mad; den har en brunlig grå farve, mest på grund af mineralforurening. At udsætte miljøet for dette salt via afstrømning kan have nogle utilsigtede konsekvenser, herunder negative virkninger på planter, vanddyr og vådområder.
Men det er en billig og effektiv måde at beskytte veje mod is på grund af et enkelt videnskabeligt princip:frysepunktsdepression af løsninger. Frysepunktet for rent vand, temperaturen, ved hvilken det bliver til is, er 32 grader Fahrenheit. Så hvis der er sne, slud eller iskold regn, og jorden er 32 F eller koldere, fast is vil dannes på gader og fortove.
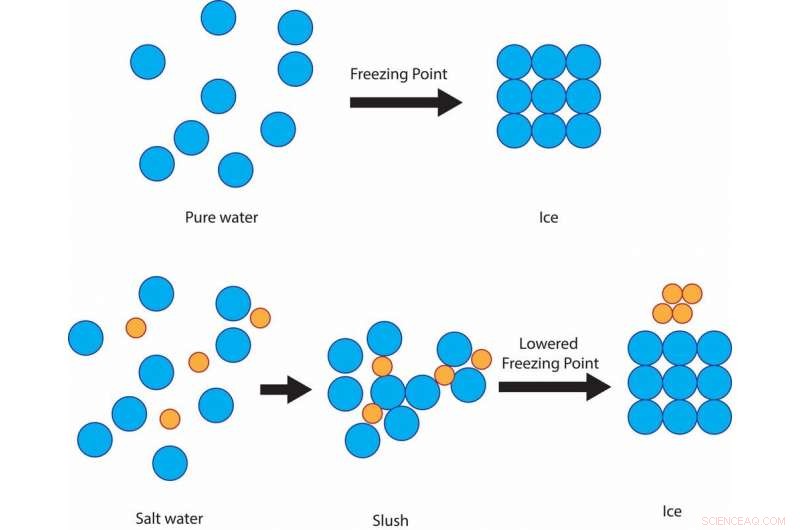
Salt forhindrer vandmolekylerne i at størkne til iskrystaller ved 32 F, i stedet forbliver slushy ved den temperatur, før det til sidst fryser omkring 15 F.Kredit:Julie Pollock, CC BY-ND
Hvis vandet blandes med salt, selvom, opløsningens frysetemperatur er lavere end 32 F. Saltet hindrer vandmolekylernes evne til at danne faste iskrystaller. Graden af frysepunktsdepression afhænger af, hvor salt opløsningen er.
Det er vigtigt at bemærke, at saltet skal være i en opløsning med flydende vand, for at dette princip kan overholdes. Derfor sprøjter mange byer en saltopløsning, inden der dannes is.
Salt, der dumpes oven på is, er afhængig af solen eller friktionen af bildæk, der kører over det, for i første omgang at smelte isen til en slush, der kan blandes med saltet og derefter ikke genfryser. Forbehandling med fast salt er afhængig af, at den varmere vejbelægning i første omgang smelter sne eller iskold regn, så den kan blandes ordentligt med saltet. Det er også derfor, at forbehandling af broer-som er koldere end andre veje-typisk ikke fungerer, og hvorfor du ser "bro fryser før vej" -skilte.
Disse saltopløsninger reducerer frysningstemperaturen af vand til omkring 15 F. Så, desværre for folk, der står over for virkelig kolde vikarer, behandling med salt vil ikke slippe af med is på deres veje.
En alternativ strategi, der bruges ved disse lavere temperaturer, er at lægge sand på isen. Sand ændrer ikke smeltetemperaturen, det giver bare en ru overflade til dine dæk for at forhindre glidning og glidning.
Videnskaben om frysepunktsdepression kan anvendes på enhver løsning, og mange forskergrupper har fokuseret på at udvikle alternativer med færre negative miljøkonsekvenser. De inkluderer tilsætningsstoffer som melasse og sukkerroer. Så måske kan du se frem til at rense ikke bare hvidt salt af bunden af dine jeans efter en vintertur, men også lyserødt salt.
Denne artikel er genudgivet fra The Conversation under en Creative Commons -licens. Læs den originale artikel. 
Sidste artikelBitter raps
Næste artikelNatrium er det nye lithium:Forskere finder en måde at øge natriumionbatteriets ydeevne på
 Varme artikler
Varme artikler
-
 Grønnere biomaterialer og stilladser, der bruges i regenerativ medicinKredit:Pixabay/CC0 Public Domain Grøn fremstilling bliver en stadig mere kritisk proces på tværs af industrier, drevet af en stigende bevidsthed om de negative miljø- og sundhedsmæssige konsekvens
Grønnere biomaterialer og stilladser, der bruges i regenerativ medicinKredit:Pixabay/CC0 Public Domain Grøn fremstilling bliver en stadig mere kritisk proces på tværs af industrier, drevet af en stigende bevidsthed om de negative miljø- og sundhedsmæssige konsekvens -
 Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove
Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove -
 Mikrobølger afslører detaljeret struktur af molekylær motorSom en makroskopisk motor, det kunstige motormolekyle har en stator (nederst) og en rotor (øverst), forbundet med en aksel. Kredit:Sérgio Domingos / DESY Et team af forskere har brugt mikrobølger
Mikrobølger afslører detaljeret struktur af molekylær motorSom en makroskopisk motor, det kunstige motormolekyle har en stator (nederst) og en rotor (øverst), forbundet med en aksel. Kredit:Sérgio Domingos / DESY Et team af forskere har brugt mikrobølger -
 Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme
Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme
- Langsom lys i et optisk hulrum med mekaniske resonatorer og spejle
- Den amerikanske administrerende direktør giver Oxford University 189 millioner dollars til AI-studi…
- Nanofotonik teknologi muliggør en ny slags optisk spektrometer
- Nyt tidligt varslingssystem for naturbrande kunne forhindre forårsflammer
- Fleksible arbejdsordninger mindsker lønforskellen for mødre
- Ekspert diskuterer observation af kognitive triggere for ekstremistisk vold gennem hjernescanninger


