Kemikalier kan ændre deres identitet, takket være væskerne, hvor de opholder sig
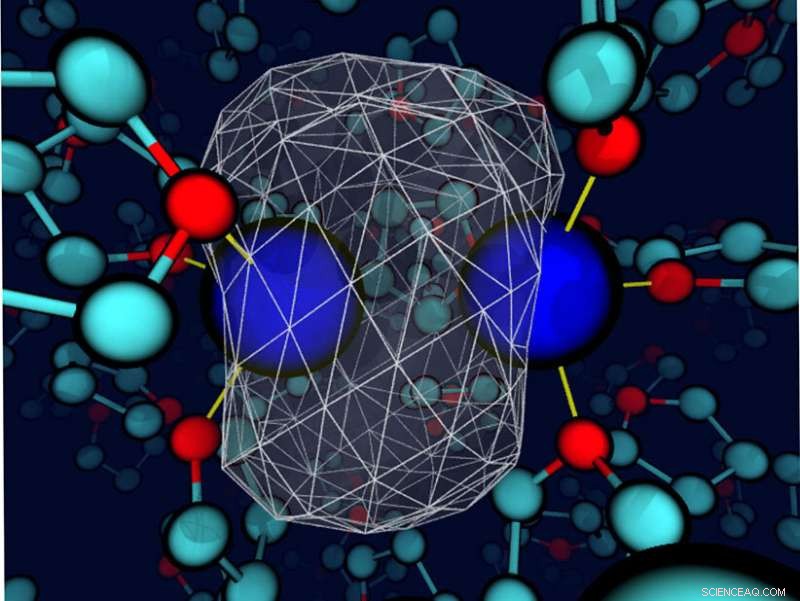
Et "øjebliksbillede" afslører, at det omgivende tetrahydrofuranopløsningsmiddel deformerer bindingselektrondensiteten omkring et opløst natrium. Natriumkernerne er blå kugler; valenselektronernes tæthed er repræsenteret som en transparent hvid overflade med et hvidt trådnet, der omslutter det meste af ladningstætheden. Bindingerne mellem natrium og nærliggende opløsningsmidlers iltsteder er tynde gule linjer. Kredit:Devon Widmer, University of California, Los Angeles
Smid et par hele mandler i en krukke fuld af hasselnødder. Ryste. Nødderne hopper mod hinanden, men de reagerer ikke. Det er sådan nogle mennesker tænker på reaktioner, der sker inde i væsker. De opløste stoffer (mandler) reagerer med hinanden i et hav af opløsningsmidler (hasselnødder). Men en ny undersøgelse viser, at det ikke altid er tilfældet for rigtige kemiske reaktioner. Under de rette forhold, opløsningsmidlet kan ændre det opløste stofs kemiske identitet.
Mange kemiske reaktioner, især dem, der er relevante for at holde mennesker og planter i live, ske i løsning. Denne forskning viser, at i mange sådanne reaktioner, opløsningsmidlet er ikke blot en tilskuer. Det betyder omstilling af forventninger og beregningsmodeller. Fordi de samme regler kunne gælde i kemilaboratorier, forskere skal muligvis vælge deres opløsningsmidler med mere omhu. Opløsningsmidlerne kunne kontrollere eller ændre den kemiske identitet af det opløste stof.
Selvom opløsningsmidler i nogle tilfælde er nøje udvalgt, væskerne betragtes ofte blot som et medium for at tillade reaktanterne at støde på hinanden. Imidlertid, opløsningsmidlet kan spille en større rolle. Her, forskere fandt ud af, at når opløsningsmidlet og det opløste stof interagerer (energetisk i samme rækkefølge som en brintbinding), opløsningsmidlet kan styre bindingsdynamikken og den kemiske identitet af simple opløste stoffer. Forskerne kom til denne konklusion ved at studere en natriumdimer i det svagt polære opløsningsmiddel tetrahydrofuran. Bindingsinteraktioner mellem opløsningsmidlet og natriumatomer førte til unikke koordinationstilstande. Disse stater skulle krydse en fri energibarriere, i det væsentlige gennemgår en kemisk reaktion, at interkonvertere. Yderligere, hver koordinationstilstand havde sin egen dynamik og spektroskopiske signaturer. Selvom kemikere længe har været opmærksomme på virkningen af opløsningsmidler i visse tilfælde, denne forskning fremhæver værdien af omhyggeligt at vælge opløsningsmidlet for at skabe et specifikt miljø i visse kondenserede kemiske systemer.
 Varme artikler
Varme artikler
-
 Bæredygtigt biomedicinsk udstyr til brug i regenerativ medicinKredit:CC0 Public Domain UPV/EHU-forskere har udviklet et biomedicinsk apparat, der består af biprodukter fra fødevareindustrien, og som udviser fremragende egenskaber til brug i regenerativ medic
Bæredygtigt biomedicinsk udstyr til brug i regenerativ medicinKredit:CC0 Public Domain UPV/EHU-forskere har udviklet et biomedicinsk apparat, der består af biprodukter fra fødevareindustrien, og som udviser fremragende egenskaber til brug i regenerativ medic -
 Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m
Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m -
 Nogle eksisterende kræftbekæmpende lægemidler kan delvis virke ved at målrette mod RNA, undersø…Professor Matthew Disney ledede den nye undersøgelse. Kredit:Scripps Research Styrker opfattelsen af, at RNA bør betragtes som et vigtigt lægemiddelopdagelsesmål, forskere ved Scripps Research har
Nogle eksisterende kræftbekæmpende lægemidler kan delvis virke ved at målrette mod RNA, undersø…Professor Matthew Disney ledede den nye undersøgelse. Kredit:Scripps Research Styrker opfattelsen af, at RNA bør betragtes som et vigtigt lægemiddelopdagelsesmål, forskere ved Scripps Research har -
 Hvor godt mælk er et dyrs krop godtNIST -kemiker Connie Remoroza i sit laboratorium, arbejder på at forberede en mælkeprøve fra National Zoo til ionisering i massespektrometeret. Kredit:R. Press/NIST Det er blevet kaldt verdens mes
Hvor godt mælk er et dyrs krop godtNIST -kemiker Connie Remoroza i sit laboratorium, arbejder på at forberede en mælkeprøve fra National Zoo til ionisering i massespektrometeret. Kredit:R. Press/NIST Det er blevet kaldt verdens mes
- Brug af forskning til at afslutte moderne slaveri
- Ny satellitteknologi tilbyder et mere detaljeret kort over antarktiske gletsjere i bevægelse
- Kinas moon rover forbereder sig på en hård tur på den mørke side
- Lermineraler på Mars kan have dannet sig i det oprindelige dampbad
- Vil boble-drevne mikroroketter zoome gennem den menneskelige mave?
- Undersøgelse afslører forskellige magnetiske felter i sol-type stjernedannende kerner


