Biofunktionaliseret keramik til reparation af kranieknogledefekter - in vivo undersøgelse
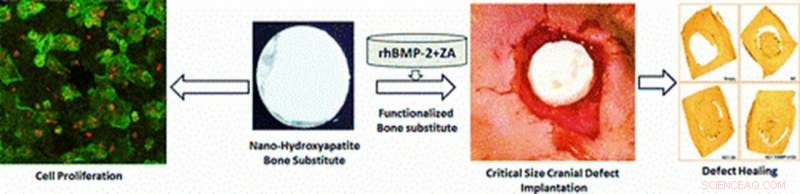
Illustration af de multifunktionelle materialer eksperimentelt udviklet i undersøgelsen til in vivo anvendelser af celleproliferation og kranioplastik. Defektheling i en gnavermodel observeres efter 12 ugers stilladsimplantation på defektstedet med celleproliferation, radiografi, mikro-CT og histologiske analyser. Billedkredit:ACS Applied Materials &Interfaces. Kredit: Multifunktionelle materialer , doi:https://doi.org/10.1088/2399-7532/aafc5b
Fremskridt inden for materialevidenskab og produktionsteknologi har muliggjort knoglevævsteknologi (BTE) strategier, der genererer komplekse stilladser med kontrolleret arkitektur til knoglereparation. De nye biomaterialer kan funktionaliseres yderligere med bioaktive molekyler til biokompatibilitet ved at øge osteoinduktivitet (inducere osteogenese for at starte knogleheling). I en nylig undersøgelse offentliggjort i Multifunktionelle materialer, IOP Videnskab , Arun Kumar Teotia og kolleger ved Institut for bioteknik, ortopædi, kemiteknik og biomedicinsk teknik, i Indien, Finland og Sverige udviklede en roman, multifunktionel, dobbeltlags sammensat stillads (BCS). Det nye materiale indeholdt keramisk nano-cement (NC) og det makroporøse kompositstillads (CG) for at efterligne knoglearkitektur under knoglereparation.
For at funktionalisere stilladserne, materialeforskerne tilføjede rekombinant humant knoglemorfogenetisk protein-2 (rhBMP-2) (BMP) og zoledronsyre (ZA). Forskerne foreslog, at de sammensatte stilladser ville understøtte spredningen af osteoblast-stamceller, sideløbende med den kontrollerede frigivelse af ladede bioaktive molekyler for at inducere knogleregenerering. Forskere i det samme forskerhold havde tidligere udviklet et lignende multifunktionelt materiale for at teste dets indledende virkning under en in vivo pilotundersøgelse.
I denne undersøgelse, Teotia et al. observerede en højere mængde mineraliseret væv (MT) med funktionaliserede stilladser inden for 12 uger efter in vivo implantation i en større gruppe rotter med 8,5 mm kritiske kraniedefekter. De kombinerede dobbeltlagede kompositstilladser (BCS) funktionaliserede med zoledronsyre (ZA) (til dannelse af BCS+ZA) indeholdt den højeste MT-aflejring (13,9 mm) 3 ). Efterfulgt af det makroporøse kompositstillads (CG) funktionaliseret med BMP og ZA (CG+BMP+ZA) ved 9,2 mm 3 og BCS+ZA+BMP med 7,6 mm 3 af MT -aflejring.
MT-værdierne registreret i undersøgelsen under knogleregenerering var signifikant højere end osteogenesehastigheder på de ikke-funktionaliserede CG- eller BCS-stilladser alene (uden bioaktive molekyler). Resultaterne understøttede BTE-strategierne udviklet i undersøgelsen for at danne et osteo-fremmende multifunktionelt stillads, der kunne implanteres in vivo for at reparere kritiske defekter.
Et unikt træk ved knoglevæv er dets evne til at hele uden ardannelse som et meget dynamisk væv med betydeligt potentiale for regenerering. Naturlig knogledannelse sker enten via endokondral ossifikation i rørformede knogler (fx phalanges, lårben) eller under bruskaflejring, efterfulgt af ossifikation. I en tredje proces, intramembranøs direkte ossifikation kan forekomme i flade knogler (kranie, bækken) uden bruskdannelse. Regenerering er en langsom proces i flade knogler (kranie, bækken) på grund af begrænsede mesenkymale stamceller (MSC'er), kræver større celle rekruttering fra periosteum eller dura.
Som resultat, helbredelse af kritiske størrelsesdefekter i flade knogler, såsom kraniet er en udfordring, der kræver optimerede BTE -strategier. Autograft knogleflapper blev først foretrukket til kranioplastik for at minimere immunologiske reaktioner, infektioner og fremmedlegemegenkendelse. Derefter, forskere udviklede vaskulariserede calvarium -knogletransplantater som et foretrukket valg til kranial rekonstruktion i yderligere undersøgelser. Imidlertid, de tilknyttede transplantationsstrategier introducerede komplikationer under materialeresorption efter implantation og reparation, sideløbende med andre kliniske komplikationer ved kontaktstedet mellem implantatet og den oprindelige knogle. Regenerering og celleinfiltration i en calvariaflap afhænger i høj grad af progenitorceller, der kan migrere fra den underliggende dura eller de overliggende perikraniale lag, at differentiere til aktive osteogene celler til heling. Hvis cellemigration er okkluderet fra de to membraner (dura og pericranium), knogledannelsen ville være væsentligt lavere.
Forskere havde allerede fastslået, at de to membraner var vigtige for at spille en specifik rolle under regenerering, selvom periosteums rolle i kraniumregenerering er mindre signifikant med alderen. I denne undersøgelse, Teotia et al. udviklet hypotesen om, at en osteokonduktiv overflade kunne opretholde krydssnak mellem dura og perikranielle lag for tidlig vaskularisering og klinisk succes. For at opnå dette, de genererede en dobbeltlags stilladsarkitektur, der integrerede en resorberbar bifasisk nano-hydroxyapatit-calciumsulfat keramisk nano-cement (NC) i det øvre lag og silke-bioglas-hydroxyapatit-komposit porøs kryogel (CG) som et underliggende lag.
Teotia et al. brugte det dobbeltlagede design til at integrere den mekaniske styrke af NC som et beskyttende øvre lag og det porøse sammensatte CG-lag som en overflade til cellevedhæftning, infiltration, spredning og vaskularisering. Forskerne forventede, at de designede overflader ville opretholde kommunikationen mellem den underliggende dura og de overliggende periosteale membraner. De funktionaliserede de nye materialer og implanterede dem in vivo i Wistar -rotter med kritiske kranielle defekter for at evaluere effekten af dobbeltlags porøs arkitektur på osteokonduktion og knogledannelse i prækliniske, translationelle undersøgelser.
Under materialefremstilling, videnskabsmændene støbte NC ind i en konkav-konveks formet arkitektur for at matche kraniets form og lod den sætte sig, at konstruere multifunktionelle dobbeltlagede stilladser til kranioplastik. De dannede cirkulære BCS-skiver sammensat af øvre NC og nedre CG og udførte kirurgiske procedurer på dyremodellerne. Under operationen, Teotia et al. implanterede stilladsskiverne på defektstedet og udførte ex vivo mikro-CT og radiologisk analyse på det udskårne og høstede calvarium efter at have ofret dyremodellerne, 12 uger efter diskimplantation.
Forskerne gennemførte radiologiske analyser af knogledannelse på defektstedet for at observere forbenet vævsdannelse, ved hjælp af nanoScan in vivo-scanneren til radiografiske projektioner af defekten. De brugte mikro-CT-analyse til at påvise dannelse af højt mineraliseret væv (MT) og undersøge defektfyldning i den 8,5 mm kirurgisk inducerede cirkulære defekt (interesseområde). I 12 uger, mineralisering opnåede ikke perfekt lukning i dyremodellen. Forskerne brugte billedkvantificeringssoftware til at vise den højeste mængde mineraliseret vævsdannelse i BCS+ZA-gruppen, efterfulgt af CG+ZA+BMP -gruppen, efterfulgt af CG+ZA+BMP og BCS+ZA+BMP grupper.
Efter høst, forskerne fikserede kranieprøverne til histologisk analyse og udførte hæmatoxylin og eosin (H&E) og Massons trikromfarvning af rottecalvarier. De viste, at både det porøse sammensatte stillads (CG) og det dobbeltlagede stillads (NC+GC) (BCS) integrerede godt med eksisterende knogle på stedet for defekten. Stilladserne gav porøse overflader til grundig celleinfiltration. Teotia et al. viste også, at funktionaliserede stilladser havde konsekvent højere MT-dannelse via histologiske assays på grund af tilstedeværelsen af osteokonduktive og osteoinduktive faktorer i de bioaktive molekyler sammensat sammenlignet med de ikke-funktionaliserede grupper. Histologiresultaterne var i overensstemmelse med mikro-CT-resultaterne i undersøgelsen.
På denne måde Teotia et al. viste, at multifunktionelle kompositstilladser kunne erstatte auto- eller allotransplantater i stor størrelse, knoglefejl i kraniet. De viste, at de multifunktionelle materialer var i stand til at inducere tidlig vaskularisering og forbedre mineralisering in vivo. Som forventet, de sammensatte stilladser tillod porøs osteoledende kommunikation mellem tidlig celleinfiltration fra periosteum og de underliggende dura-lag under hurtig knogledannelse. De multifunktionelle materialer lover at forbedre knoglemineralisering og tidlig defektheling efter implantation. Teotia et al. foreslå at foretage yderligere undersøgelser i store prækliniske dyremodeller for at optimere og oversætte det nye biomateriale til kliniske anvendelser.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Hvordan vi fandt den tidligste glasproduktion syd for Sahara, og hvad det betyderGlasrelaterede artefakter udgravet fra Igbo Olokun, Ile Ife. Til venstre:glasperler, Til højre:fragmenter af glas fremstiller digler. Kredit:Abidemi Babatunde Babalola Menneskehedens historie fra
Hvordan vi fandt den tidligste glasproduktion syd for Sahara, og hvad det betyderGlasrelaterede artefakter udgravet fra Igbo Olokun, Ile Ife. Til venstre:glasperler, Til højre:fragmenter af glas fremstiller digler. Kredit:Abidemi Babatunde Babalola Menneskehedens historie fra -
 Bekæmpelse af et mægtigt ukrudtKredit:CC0 Public Domain Ukrudt er irriterende i enhver situation. Nu, forestil dig et ukrudt, der er så besværligt, at det har muteret til at modstå flere herbicider. Palmer amaranth, et medlem a
Bekæmpelse af et mægtigt ukrudtKredit:CC0 Public Domain Ukrudt er irriterende i enhver situation. Nu, forestil dig et ukrudt, der er så besværligt, at det har muteret til at modstå flere herbicider. Palmer amaranth, et medlem a -
 Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt
Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt -
 Thinsulate temperaturvurderingerSelvom ekstrem varme og kulde begge forårsager ubehag, er eksponeringen for kolde temperaturer dødbringende, fordi den menneskelige krop ved lave temperaturer mister varmen hurtigere, end den producer
Thinsulate temperaturvurderingerSelvom ekstrem varme og kulde begge forårsager ubehag, er eksponeringen for kolde temperaturer dødbringende, fordi den menneskelige krop ved lave temperaturer mister varmen hurtigere, end den producer


