Teknologi afslører tidligere upåviselig proteinsignalaktivitet i diabetes, Kræft

Kredit:Analytisk kemi, maj 2019
Proteiner er cellens arbejdsheste. Deres aktivitet styres ofte ved at tilføje eller fjerne kemikalier kaldet fosfater, som at tænde eller slukke for en elektrisk strøm. Måling af hvor mange proteiner der fosforyleres, eller tændt, har været en vejspærring for forskning. Fordi fosforylerede proteiner er svære at få i store mængder, de kan være svære at analysere, selv ved at bruge avancerede instrumenter såsom et massespektrometer.
Pacific Northwest National Laboratory-forskere har udtænkt en måde at måle og skelne mellem små mængder fosforylerede proteiner, en tilgang, der kunne bruges i forskning til at hjælpe med at behandle sygdomme som diabetes og kræft. Undersøgelsen vises som forsideartikel for tidsskriftet den 7. maj Analytisk kemi .
At skelne phosphorylerede proteiner
I et massespektrometer, molekyler samler sig i en fælde lige foran måleapparatet - som køretøjer, der venter ved en afmålt motorvejspåkørsel, sagde medforfatter Karin D. Rodland, en PNNL laboratoriestipendiat og biomedicinsk forsker. Fælden frigives, når den akkumulerer nok molekyler. Dette lader molekylerne bevæge sig fremad ligesom køretøjerne, når rampelyset bliver grønt.
Men når lave niveauer af phosphorylerede proteiner er i en prøve, deres signal er ofte for svagt til, at et massespektrometer kan registrere, så molekylerne sætter sig fast, allerede inden de bliver målt.
I dette studie, forskere søgte at forstærke signaler for at omgå barrieren og gøre selv de lave niveauer af proteiner målbare. For at kunne gøre dette, holdet implementerede en eksisterende teknik kaldet isobarisk mærkning, som kemisk mærker prøver. Hvert tag er unikt og klæber til og identificerer alle proteiner i en given prøve. Vigtigere, når de individuelt mærkede prøver er blandet, de bliver single, kemisk identisk prøve.
"I øjnene af massespecifikationen, " sagde den tilsvarende forfatter Tao Liu, en biomedicinsk videnskabsmand ved PNNL, "prøven viser sig som én identitet."
Klogt, forskere mærkede isobarisk og blandede et "boostende" materiale med undersøgelsesprøverne, der var begrænset i mængde, ved et boosting/sample-forhold på 30 til 1. Dette boostningsmateriale er biologisk lig undersøgelsesprøverne, så proteinkatalogerne ligner hinanden og er let tilgængeligt i en meget større mængde. For eksempel, blandede cellelinjer kan bruges til at efterligne væv.
Kombinationen af boostningsmaterialet og undersøgelsesprøverne gjorde det overordnede signal stort nok til at blive detekteret af massespecifikationen. Dette narrede i det væsentlige instrumentet - som ikke er i stand til at foretage nogen målinger, når prøven er for lille - til at give grønt lys for hele prøven til analyse.
Teknologien er meget som biler og lastbiler, der sorterer sig selv efter hastighed, når de løber ind på motorvejen, og derefter udvælge bilerne efter deres farver, sagde Rodland. Disse køretøjer ville aldrig være blevet sorteret, hvis de ikke havde fået "go"-signalet fra måleren.
Da massespecifikationen brød den isobarisk mærkede og blandede prøve fra hinanden til analyse, forholdet, hvor taggene optrådte, gjorde det muligt for forskerne at bestemme, hvor meget af hvert peptid der var i hver original prøve.
Fremskridt i sygdomsdetektion
Ved at bruge den isobariske mærknings-/forstærkningsstrategi, holdet viste først, at tre forskellige cellelinjer af akut myeloid leukæmi - en type kræft, der begynder i knoglemarven - effektivt kan skelnes ud fra deres proteinaktivitetsprofiler, ved brug af et relativt lille antal celler.
Forskere rettede derefter deres opmærksomhed mod bugspytkirtel-øer, som spiller en central rolle i diabetes. Disse celleklynger producerer hormoner - insulin og glukagon - der arbejder sammen for at forhindre, at blodsukkerniveauet bliver for højt eller for lavt. Cellerne er mål hos patienter med type 1, eller insulinafhængig, diabetes. Imidlertid, proteinaktiviteten i menneskelige øer er vanskelig at studere på grund af deres begrænsede proteinindhold. Ved at bruge den nye teknik, forskere analyserede ændringer i proteinaktivitet i menneskelige øer som reaktion på behandling - et længe søgt ønske for læger, der overvåger deres patienter.
"Dette vil give os ny indsigt i, hvad der sker, når insulinproducerende celler dør hos patienter med diabetes, " sagde Wei-Jun Qian, den anden tilsvarende forfatter til papiret og en biomedicinsk videnskabsmand ved PNNL. "Evnen til at spore proteinaktivitet mere stringent vil hjælpe os med at forstå, hvilke signalveje der er involveret i celledød."
I horisonten
Den nye tilgang lover forskellige former for biologisk og biomedicinsk forskning, når prøvemateriale er knap. Anvendelser kan omfatte sammenligning af celler før og efter lægemiddelbehandling, test af forskellige doser, eller at studere tidspunktet for proteinaktivering eller -deaktivering.
"Mulighederne er uendelige, " sagde Liu. "Du kan foretage kvantificering i meget stor skala, og du kan også blande mange forskellige forhold, du vil studere, i ét eksperiment."
 Varme artikler
Varme artikler
-
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere, -
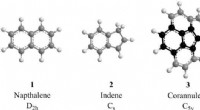 Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit
Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit -
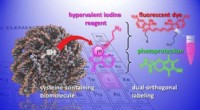 Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl
Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl -
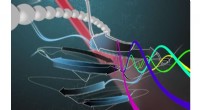 Hurtig screeningsmaskine kan læse og adskille proteinsekvenserKunstnere gengivelse af sorteringsprocessen for molekyler i Bio-Enigma maskinen. Ultrahurtig laser-probing spektroskopi afslører proteiners molekylære struktur. Kredit:Nasim Motalebi De strukturel
Hurtig screeningsmaskine kan læse og adskille proteinsekvenserKunstnere gengivelse af sorteringsprocessen for molekyler i Bio-Enigma maskinen. Ultrahurtig laser-probing spektroskopi afslører proteiners molekylære struktur. Kredit:Nasim Motalebi De strukturel
- Forældede dæmninger har nøglen til vandkvaliteten
- Team udvikler miljøvenligt, flammehæmmende kulstofplast ideel til genbrug
- Objekter kan nu ændre farver som en kamæleon
- Forskere finder, at diffusion spiller en usædvanlig signalrolle i Drosophila-embryoner
- Amazon, Microsoft, at sætte verden i fare for dræber AI:rapport
- Sådan gør du Multiplying & Factoring Polynomials


