Nyt design af bioaktive peptidnanofibre, der holder både temperaturreversibilitet og stivhedskontrol

Temperaturrespons af peptidet. Det danner fast (gel) ved 20 grader Celsius og flydende (sol) ved 80 grader Celsius angivet med hvide parenteser, og denne funktion er reversibel. Kredit:Takahiro Muraoka, TUAT
Et samarbejde hovedsageligt ledet af forskere fra Tokyo University of Agriculture and Technology (TUAT) i Japan har udviklet en ny metode til molekylært design til at kontrollere både temperaturreversibilitet og stivhed af nanofibre, der er geldannende peptider. Peptid-nanofiberhydrogelen kan bruges som biomedicinsk materiale. Denne metode vil tillade peptid nanofibre for mere biomedicinsk anvendelig.
Forskerne offentliggjorde deres resultater den 8. juli i Chemistry-A European Journal , som blev fremhævet på forsiden og coverprofilen.
Generelt, nogle peptider danner nanofiberhydrogeler. Disse peptider er korte kæder af naturlige aminosyrer, der findes i alle levende organismer. Da disse er biovenlige, de har været meget brugt i medicin såsom vævsgenvindingsmaterialer, regenerative medicinske materialer, ekstracellulære matricer, cellekulturmaterialer, og medicinafgivelsesbeholdere.
"For nogle medicinske anvendelser af nanofiberpeptider, vi er nødt til at udvikle en teknik til at kontrollere både stivhed (mekanisk styrke) og temperaturrespons skiftende mellem gel (fast) og sol (væske), "sagde Takahiro Muraoka, Ph.D., tilsvarende forfatter på papiret og lektor ved Institut for Anvendt Kemi, Graduate School of Engineering ved TUAT. "Det er, imidlertid, svært at forbedre begge funktioner på samme tid. For eksempel, når man øger stivheden af en peptid nanofiber ved at erstatte en simpel aminosyre alanin til en mere hydrofob aminosyre phenylalanin, det er kendt, at temperaturrespons ofte går tabt."
I deres eksperimenter, de fandt ud af, at en aminosyreerstatning, som man mente at lavede en blødere gel, uventet dannede en hårdere gel. De brugte 5 sæt forskellige peptider, der havde 16 aminosyrer. Interessant nok, et bestemt peptid mistede ikke temperaturrespons. Peptidet (koncentration ved 1 % i opløsning) dannede gel (fast) ved 20°C (68°F), og når temperaturen steg til 80°C (178°F), blev gelen blød (flydende). Når temperaturen sænkes fra 80°C til 20°C, den faste gel blev igen dannet. "Denne temperatur reversible funktion er anvendelig til lægemiddeltilførsel ved lokal injektion, "sagde Muraoka.
De erstattede alanin i midten af peptidet til glycin, den enkleste aminosyre. Glycinudskiftningen gør normalt gelen blødere. De brugte almindelig analytisk instrumentering som f.eks. CD, IR, og TEM -mikroskopi for præcist at forstå, hvordan gelen blev dannet. De brugte også en beregningsmetode, kaldet molekylær dynamik simulering. "Baseret på vores resultater, vi er nu i stand til at designe peptider bedre ved computersimulering, " sagde Muraoka.
Desuden, peptidnanofiberen var celleklæbende, som er velegnet som biomateriale til cellekultur og vævsregenerering. "Denne forskning vil åbne nye veje til at designe peptid nanofibre, der er mere biomedicinsk anvendelige, " tilføjede Muraoka.
 Varme artikler
Varme artikler
-
 Q&A:Den fascinerende baggrund for det periodiske system, som er ved at fylde 150 årKredit:CC0 Public Domain Det periodiske system er blevet et ikon for videnskab. Dens rækker og søjler giver en pæn måde at fremvise elementerne - ingredienserne, der udgør universet. Det virker i
Q&A:Den fascinerende baggrund for det periodiske system, som er ved at fylde 150 årKredit:CC0 Public Domain Det periodiske system er blevet et ikon for videnskab. Dens rækker og søjler giver en pæn måde at fremvise elementerne - ingredienserne, der udgør universet. Det virker i -
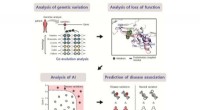 Evolutionær koblingsanalyse identificerer virkningen af sygdomsassocierede varianterSkematisk af den udviklede metode til at identificere virkningen af sygdomsassocierede varianter. Kredit:POSTECH Forudsigelse af virkningen af DNA-sekvensvarianter er vigtig for sortering af s
Evolutionær koblingsanalyse identificerer virkningen af sygdomsassocierede varianterSkematisk af den udviklede metode til at identificere virkningen af sygdomsassocierede varianter. Kredit:POSTECH Forudsigelse af virkningen af DNA-sekvensvarianter er vigtig for sortering af s -
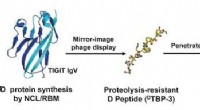 Checkpoint blokade af et D-peptid til cancer immunterapiKredit:Angewandte Chemie Vores immunsystem burde være i stand til at genkende og dræbe tumorceller. Imidlertid, mange tumorer bedrager immunsystemet. For eksempel, de inducerer T-cellers såkaldte
Checkpoint blokade af et D-peptid til cancer immunterapiKredit:Angewandte Chemie Vores immunsystem burde være i stand til at genkende og dræbe tumorceller. Imidlertid, mange tumorer bedrager immunsystemet. For eksempel, de inducerer T-cellers såkaldte -
 Sådan finder du antallet af elektronerAtomer danner molekyler og forbindelser ved at dele elektroner for at skabe kemiske bindinger. At forstå arten af denne binding begynder med at kende antallet af elektroner, der er forbundet med
Sådan finder du antallet af elektronerAtomer danner molekyler og forbindelser ved at dele elektroner for at skabe kemiske bindinger. At forstå arten af denne binding begynder med at kende antallet af elektroner, der er forbundet med
- SpaceX lancerer AI-robot, stærk kaffe til stationsbesætning
- En webapplikation til at udtrække nøgleinformation fra tidsskriftsartikler
- Spionerer en sjælden ring af ild omkring Venus i ringere konjunktion
- Mælkevejens stamtræ dechifreret
- Rummet kan løse vores truende ressourcekrise – men selve rumindustrien skal være bæredygtig
- Kunstig intelligens:Mod en bedre forståelse af de underliggende mekanismer


