Fornemmer sødme på molekylært niveau
Kredit:American Chemical Society
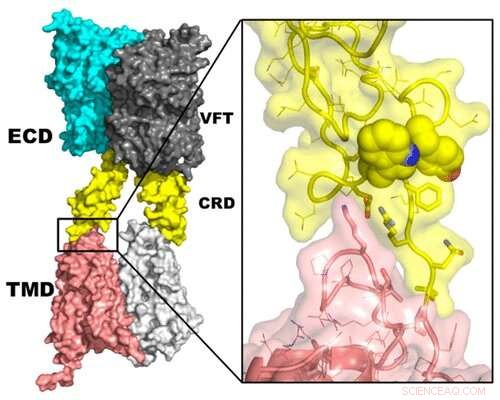
Uanset om det er chokoladekage eller pastasauce, følelsen af sødme spiller en stor rolle i den menneskelige kost og opfattelsen af andre smagsvarianter. Mens der er meget kendt om de individuelle proteiner, der signalerer "sød, "ikke meget vides om, hvordan proteinerne arbejder sammen som en receptor for at opnå denne bedrift. Nu, i ACS Chemical Neuroscience , forskere rapporterer om et molekylært kig på receptoren, som en dag kan føre til bedre smagende mad.
Smagsreceptorer er medlemmer af en familie af G-protein-koblede receptorer, der kommunikerer information ind i kroppens celler. I særdeleshed, T1R2- og T1R3-proteinerne danner et kompleks kendt som den søde receptor, der er ansvarlig for perceptionen af molekyler, såsom naturligt sukker, kunstige sødestoffer, og nogle proteiner og aminosyrer. Selvom der for nylig er opnået information om receptorens struktur og funktion, det nøjagtige layout af proteinerne i komplekset og dets aktiveringsproces er ikke helt klart. Så, Ruhong Zhou og kolleger satte sig for at udvikle og analysere teoretiske strukturer af receptoren.
Forskerne brugte eksisterende data om T1R2- og T1R3-proteinerne til at generere detaljerede computermodeller af hver struktur. Derefter skabte og analyserede de modeller af proteinerne sammen i det fulde kompleks, og gennemførte dybdegående undersøgelser af to specifikke segmenter:en del, der er inde i cellemembranen, og en, der er uden for cellen. Derfra, gruppen udførte simuleringer og lærte, hvordan receptorens arkitektur kunne ændre sig, når kemikalier, såsom natrium og kolesterol, binde sig til det. Ud over, sandsynlige konfigurationer af T1R2's og T1R3's strukturer blev afsløret i forhold til hinanden, når de var i et kompleks. Disse modeller kunne tjene som grundlag for yderligere eksperimenter med, hvordan den søde receptor påvirker ernæringen, lægemiddeludvikling og menneskers sundhed generelt, siger forskerne.
 Varme artikler
Varme artikler
-
 Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska
Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska -
 Sådan beregnes teoretisk procentHver kemiske forbindelse indeholder en kombination af atomer, og en måde at forstå teoretisk procent på er at sidestille den med procentdelen af et bestemt element i en forbindelse. Denne procent
Sådan beregnes teoretisk procentHver kemiske forbindelse indeholder en kombination af atomer, og en måde at forstå teoretisk procent på er at sidestille den med procentdelen af et bestemt element i en forbindelse. Denne procent -
 Mikrodispenser til langtidsopbevaring og kontrolleret frigivelse af væskerEn større udgave af dispenseren. Kredit:KTH Det Kongelige Tekniske Institut Lab-on-a-chip (LOC) teknologi kan transformere medicin på måder, der kan sammenlignes med mikroprocessorrevolutionen - n
Mikrodispenser til langtidsopbevaring og kontrolleret frigivelse af væskerEn større udgave af dispenseren. Kredit:KTH Det Kongelige Tekniske Institut Lab-on-a-chip (LOC) teknologi kan transformere medicin på måder, der kan sammenlignes med mikroprocessorrevolutionen - n -
 Hvad er pH i destilleret vand?pH-værdien af en opløsning er et mål for koncentrationen af hydrogenioner. Selve udtrykket står løst for brintkraften, og det er den negative logaritme for den faktiske hydrogenionkoncentration
Hvad er pH i destilleret vand?pH-værdien af en opløsning er et mål for koncentrationen af hydrogenioner. Selve udtrykket står løst for brintkraften, og det er den negative logaritme for den faktiske hydrogenionkoncentration


