En ny L-fucose metabolisk vej fra strengt anaerobe og patogene bakterier
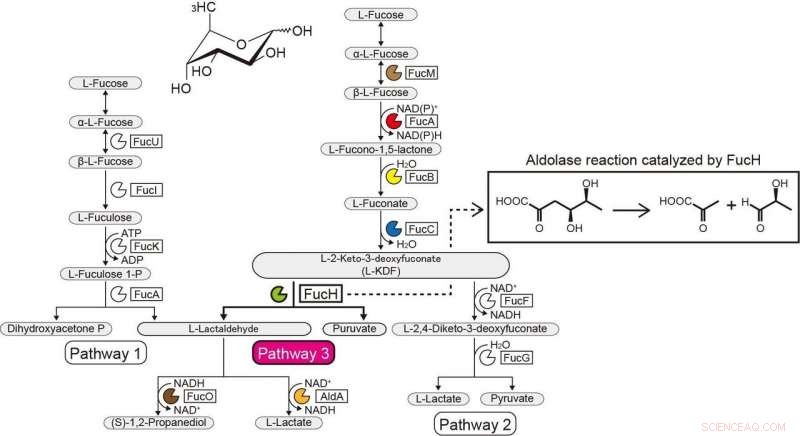
L-Fucose metaboliske veje. Kredit:Ehime University
Den genetiske kontekst i bakterielle genomer og screening for potentielle substrater kan hjælpe med at identificere de biokemiske funktioner af bakterielle enzymer. Den gramnegative, strengt anaerob bakterie Veillonella ratti besidder en genklynge, der ser ud til at være relateret til L-fucose-metabolisme og indeholder et formodet dihydrodipicolinatsyntase DHDPS/NAL-protein (FucH). Her, screening af et bibliotek af 2-keto-3-deoxysukkersyrer med dette protein og den biokemiske karakterisering af nabogener afslørede, at denne genklynge koder for enzymer i en tidligere ukendt "Route I" ikke-phosphorylerende L-fucose-vej.
Tidligere undersøgelser af andre aldolaser i DHDPS/NAL-protein-superfamilien brugte kun et begrænset antal forbindelser, og fremgangsmåden rapporteret her muliggjorde belysning af substratspecificiteterne og stereokemiske selektiviteter af disse aldolaser og sammenligningen af dem med dem af FucH. Ifølge aldol-spaltningsreaktionen, aldolaserne var specifikke for (R)- og (S)-stereospecifikke grupper i C4-positionen af 2-keto-3-deoxysukkersyre, men havde ingen strukturel specificitet eller præference for methylgrupperne ved C5- og C6-positionerne, henholdsvis.
Denne kategorisering svarede til (Re)- eller (Si)-ansigtsselektiviteten af pyruvatenaminen på (glycer)aldehydcarbonyl i aldol-kondensationsreaktionen. Disse egenskaber bestemmes almindeligvis af, om en serin- eller threoninrest er placeret i den ækvivalente position tæt på det eller de aktive steder, og sted-rettet mutagenese markant modificeret C4-OH præference og den selektive dannelse af en diastereomer. Vi foreslår, at substratspecificitet af 2-keto-3-deoxysukkersyrealdolaser blev konvergent erhvervet under evolutionen og rapporterer opdagelsen af en anden L-2-keto-3-deoxyfuconataldolase involveret i den samme ikke-phosphorylerende L-fucose-vej i Campylobacter jejuni .
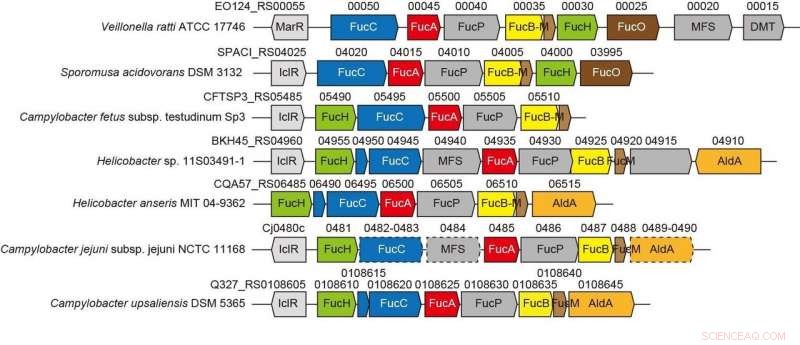
Genklynger relateret til ny ikke-phosphorylativ L-fucose-vej fra anaerobe og patogene bakterier. Kredit:Ehime University
 Varme artikler
Varme artikler
-
 Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne -
 Ingeniører gør et lovende materiale stabilt nok til brug i solcellerBare det at tilføje et omfangsrigt molekyle til overfladen af en perovskit kan endelig gøre materialet stabilt nok til at blive inkorporeret i solpaneler. Kredit:Purdue University illustration/Enzhe
Ingeniører gør et lovende materiale stabilt nok til brug i solcellerBare det at tilføje et omfangsrigt molekyle til overfladen af en perovskit kan endelig gøre materialet stabilt nok til at blive inkorporeret i solpaneler. Kredit:Purdue University illustration/Enzhe -
 Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car
Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car -
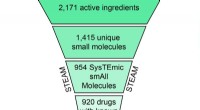 EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
- DNS-over-HTTPS:hvorfor nettets seneste privatlivsteknologi forårsager et ramaskrig
- Opvarmning af oceaner kan forårsage kollaps af isark i Antarktis, havniveaustigning
- Tre typer varmeoverførsler
- Hvordan man laver Gak med Borax
- Politisk polarisering? Giv ikke nettet skylden, siger undersøgelse
- Sådan laver du et batteri med kondensatorer


