Frys rammekemi for at låse fremtidens lægemidler op
Forskere tager øjebliksbilleder af kemiske reaktioner i en billioner af et sekund i håb om at udvikle den næste generation af antibiotika og antivirale lægemidler.
Ved hjælp af state-of-the-art laserteknologi, forskere ved Cardiff University og Rosalind Franklin Institute skaber 'freeze frame film' af kemiske reaktioner, med en hovedrolle for et specifikt enzym, der kan bruges til at lave nye lægemidler, der er aktive mod vira, såsom COVID-19.
Teknologien gør det muligt for teamet at observere den kemi, der finder sted inden for et enzym over meget korte perioder, som gør det muligt for forskere at få en forståelse af, hvordan proteinstruktur gør det muligt for den kemiske reaktion at finde sted.
Disse oplysninger vil være afgørende for teamets bestræbelser på at omstrukturere enzymet, så det hurtigt og effektivt kan bruges til at producere forbindelser med antivirale egenskaber.
For at opnå dette, de drager fordel af de kraftfulde egenskaber ved en røntgenfri elektronlaser (XFEL) placeret i Hamborg, Tyskland.
XFEL kan bruges til at opnå billeder af enzymreaktioner i krystaller ved at affyre røntgenpulser, der varer et femtosekund-en kvadrilliondel af et sekund. Det tager omkring 10 femtosekunder at oprette bindinger mellem individuelle atomer under kemiske reaktioner, hvilket betyder, at XFEL skal være i stand til at tage snapshots af strukturer, når de tager form inden for enzymet.
Gør dette til virkelighed, imidlertid, er en teknisk krævende bedrift, der ikke er blevet rapporteret for klassen af enzymer, der studeres af teamet.
Teamet vil være særlig opmærksom på et enzym, der er til stede i Streptomyces, bakterier, der sædvanligvis lever i jord og i forfalden vegetation, og som er ansvarlige for produktionen af over to tredjedele af de klinisk nyttige antibiotika, der findes i naturen.
Dette enzym letter opbygningen af en binding mellem to carbonatomer, en reaktion beskrevet af forskerne som "livets kemi på sit mest basale".
Det er vigtigt at forstå denne carbon-carbon-bindingsdannende reaktion, fordi den findes i C-nukleosider-en bestemt klasse af molekyler, der er ekstremt lovende kandidater til fremtidige antivirale lægemidler. Et eksempel på et C-nukleosid er remdesivir, udviklet af Gilead Sciences, Inc., som i øjeblikket testes rundt om i verden som en potentiel behandling af COVID-19.
"Vi skaber hovedsageligt en film om fryseramme af kemi i aktion, "sagde projektleder-efterforsker professor Nigel Richards fra Cardiff University's School of Chemistry." Kemiske bindinger dannes og brydes i meget korte perioder, alt for hurtigt til at blive set ved hjælp af andre teknikker. Den nye XFEL -teknologi tilbyder en løsning på dette problem for enzymkatalyserede kemiske reaktioner. "
"Denne state-of-the-art teknologi vil sætte os i stand til at studere biokemisk vigtige reaktioner, som vi aldrig har kunnet før, åbner op for en række nye muligheder for opdagelse og udvikling af lægemidler.
"Vores banebrydende eksperimenter vil sandsynligvis ændre vores måde at tænke på kemiske reaktioner, der finder sted inde i enzymer-en stor udfordring i kemi, biokemi og biologi. Dette vil igen give os mulighed for at konstruere biblioteker med lignende enzymer, der kan bruges til at fremstille potentielle antibiotika og antivirale forbindelser, lette lægemiddelopdagelsesprocessen. "
"C-nukleosider er fremtidens molekyler inden for opdagelse af lægemidler, "fortsatte professor Richards." Disse forbindelser er allerede meget udbredt i naturen til at dræbe bakterier og vira. "
"At være i stand til at bruge et enzym til at lave den centrale carbon-carbon-binding af C-nukleosider i laboratoriet giver os mulighed for at opbygge en række nye forbindelser, der kan vurderes som potentielle lægemidler, " han sagde.
Sidste artikelNy metode vil gøre dopingtest hurtigere
Næste artikelFremtidige hærkøretøjer kunne se en forbedring af strukturelle materialer
 Varme artikler
Varme artikler
-
 Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S
Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S -
 Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un
Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un -
 Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at
Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at -
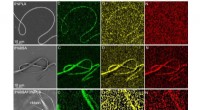 Biofysikere blander uforenelige komponenter i en nanofiberEDX -analyse af fibrene fremstillet af PLA (øverste række), BSA (midten), og PLA-BSA-blandingen i lige store mængder (bund). Farvekortlægningen svarer til de kemiske elementer, med kulstoffet, ilt, og
Biofysikere blander uforenelige komponenter i en nanofiberEDX -analyse af fibrene fremstillet af PLA (øverste række), BSA (midten), og PLA-BSA-blandingen i lige store mængder (bund). Farvekortlægningen svarer til de kemiske elementer, med kulstoffet, ilt, og
- Bekæmpelse af COVID-19 vil medføre ødelæggende økonomiske omkostninger for udviklingslandene
- Ekspert undersøger modellerne for politiske troldefarme, før de potentielt retter sig mod vestlige…
- Videnskabshyrder Perseverance rover gennem første fase af Mars stenprøvetagning
- Grønt guld:Pakistan planter hundredvis af millioner af træer
- Hvilke vulkaner er voldelige med stejle skråninger?
- Ny lyskilde giver designfrihed og øget sikkerhed


