Templating S100A9 amyloider på Aβ fibrillar overflader afsløret
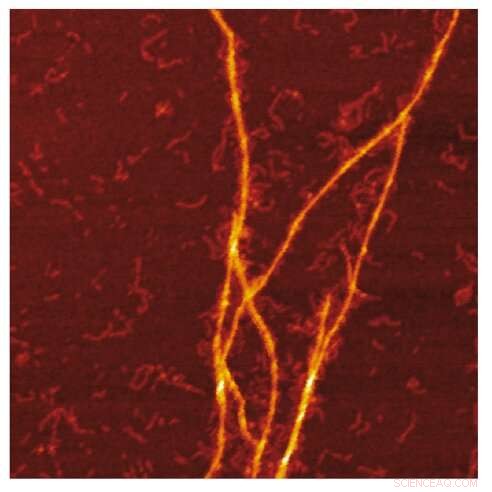
AFM -billede af amyloid -skabelonen af S100A9 -fibriller på overfladen af Aβ -fibriller. Kredit:Jonathan Pansieri
Et forskerhold ledet af Ludmilla Morozova Roche ved Umeå Universitet, Sverige, har givet den mekanistiske indsigt i proteinko-aggregering ved Alzheimers sygdom. Skabelonmekanismen for S100A9-amyloider på Aβ-fibrillære overflader under co-aggregeringsprocessen blev afsløret ved synergi af biofysiske metoder, herunder massespektrometri for ladningsdetektering, mikroskopi, kinetiske og mikrofluidiske analyser.
Amyloiddannelse er af den centrale kliniske betydning, da denne proces er involveret i mange neurodegenerative sygdomme, såsom Alzheimers, Parkinsons og andre. Disse sygdomme påvirker millioner af den aldrende befolkning på verdensplan. Ofte er det svært at trække grænsen mellem disse sygdomme, eller de kan forekomme samtidigt, som er kendt som sygdomskomorbiditet.
Mens amyloiddannelsesprocessen blev undersøgt grundigt, lidt er kendt om de specifikke mekanismer for co-aggregering af forskellige amyloidarter sammen, der ligger til grund for sygdommens komorbiditet. Ved Alzheimers sygdom, den amyloid-neuroinflammatoriske kaskade manifesterer sig i co-aggregering af Aβ med proinflammatorisk S100A9-protein, hvilket fører til intracellulær og ekstracellulær amyloid -samling, amyloid -plakaflejringer og celletoksicitet.
At dechiffrere interaktionerne mellem proinflammatorisk S100A9 -protein og Aβ42 -peptid ved Alzheimers sygdom er grundlæggende, da inflammation spiller en central rolle i sygdomsdebut. Her bruger forskerne innovativ ladningsdetekteringsmassespektrometri (CDMS) sammen med biofysiske teknikker til at give mekanistisk indsigt i co-aggregeringsprocessen og differentiere amyloidkomplekser på et enkelt partikelniveau.
Kombination af masse- og ladningsfordelinger af amyloider sammen med rekonstruktion af forskellene mellem dem og detaljeret mikroskopi afslører, at co-aggregering indebærer templating af S100A9 fibriller på overfladen af Aβ42 amyloider. Kinetisk analyse bekræfter endvidere, at de overflader, der er tilgængelige for den sekundære Aβ42 -kimdannelse, reduceres på grund af belægning med S100A9 -amyloider, mens bindingen af S100A9 til Aβ42 fibriller valideres ved et mikrofuidisk assay.
Forskerne demonstrerer, at synergi mellem CDMS, mikroskopi, kinetiske og mikrofuidiske analyser åbner nye retninger inden for tværfaglig forskning.
 Varme artikler
Varme artikler
-
 Video:Kemien bag forskellige tesmagKredit:The American Chemical Society Vidste du, at mange forskellige typer te kommer fra den samme plante? Det er ret fantastisk, i betragtning af de forskellige varianter og farver, men det, der
Video:Kemien bag forskellige tesmagKredit:The American Chemical Society Vidste du, at mange forskellige typer te kommer fra den samme plante? Det er ret fantastisk, i betragtning af de forskellige varianter og farver, men det, der -
 Forståelse af honningens kraft gennem dens proteinerKredit:American Chemical Society Honning er en kulinarisk basisvare, der kan findes i køkkener over hele verden. Mennesker har brugt honning gennem historien, og dens lange holdbarhed og medicinsk
Forståelse af honningens kraft gennem dens proteinerKredit:American Chemical Society Honning er en kulinarisk basisvare, der kan findes i køkkener over hele verden. Mennesker har brugt honning gennem historien, og dens lange holdbarhed og medicinsk -
 Selvhelbredende cement kan forvandle geotermisk industriPNNL-kemiker Carlos Fernandez og et team af forskere har udviklet en selvhelbredende cement, der kan transformere den geotermiske energiindustri. Kredit:Environmental Molecular Sciences Laboratory
Selvhelbredende cement kan forvandle geotermisk industriPNNL-kemiker Carlos Fernandez og et team af forskere har udviklet en selvhelbredende cement, der kan transformere den geotermiske energiindustri. Kredit:Environmental Molecular Sciences Laboratory -
 Hvad er specifikke specifikationer og karakterer for nitrogenrenhed?Kvælstof er en lugtfri, farveløs gas symboliseret med bogstavet N på det periodiske bord. Nitrogen har en lang række anvendelser, lige fra medicinsk forskning til fødevarepakker. Alle kommercielt o
Hvad er specifikke specifikationer og karakterer for nitrogenrenhed?Kvælstof er en lugtfri, farveløs gas symboliseret med bogstavet N på det periodiske bord. Nitrogen har en lang række anvendelser, lige fra medicinsk forskning til fødevarepakker. Alle kommercielt o
- Kinesisk lastrumfartøj lægger til kaj med orbital station
- Sådan ved du, om et nummer kan deles af 9
- Fremstilling af hybrid siliciumlasere til masseproducerede fotoniske enheder
- En bærbar måleenhed til at registrere optimal modenhed i tomater
- Ny teknik kan vise sammenhæng mellem bytte og mikroplast
- Nanoteknologi til at hjælpe med at helbrede hjerter


