Udvidelse af grænserne for kuldioxidfiksering
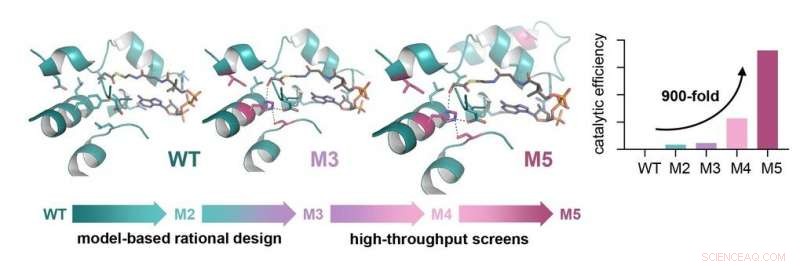
Engineering af glycolyl-CoA carboxylase (GCC), nøgleenzymet i TaCo-vejen. GCC blev udviklet på stilladset af en naturligt forekommende propionyl-CoA carboxylase (WT). Rationelt design førte til den 50 gange forbedrede version M3, og yderligere high-throughput screening muliggjorde identifikation af en 900 gange forbedret version (M5). Kredit:Max Planck Institut for terrestrisk mikrobiologi/Scheffen
Fotorespiration er en meget energikrævende proces i planter, der fører til frigivelse af tidligere fikseret CO 2 . Dermed, konstruktion af denne metaboliske proces er en nøgletilgang til forbedring af afgrødeudbyttet og til at imødegå udfordringen med stadigt stigende CO 2 niveauer i atmosfæren. Forskere ledet af Tobias Erb fra Max Planck Institute for Terrestrial Microbiology i Marburg, Tyskland, har nu haft held med at konstruere TaCo-vejen, en syntetisk fotorespiratorisk bypass. Denne nye metaboliske forbindelse åbner op for nye muligheder for CO 2 fiksering og produktion af værdiskabende forbindelser.
Alt liv er afhængig af fiksering af CO 2 gennem planter. Imidlertid, den enzymatiske effektivitet af naturlig fotosyntese er begrænset, sætter en grænse for landbrugets produktivitet og CO 2 fiksering. Fotorespiration er en afgiftningsproces i planter, der genbruger et giftigt biprodukt fra fotosyntesen, 2-phosphoglycolat. Fotorespiration er meget energikrævende og fører til frigivelse af tidligere fikseret CO 2 , dermed yderligere bremse den fotosyntetiske balance.
Forskere ledet af Tobias Erb fra Max Planck Institute for Terrestrial Microbiology har udviklet en syntetisk fotorespiratorisk bypass, der repræsenterer et alternativ til naturlig fotorespiration. I samarbejde med gruppen af Arren Bar-Even (Max Planck Institute of Molecular Plant Physiology, Potsdam-Golm), og inden for det EU-finansierede projekt Future Agriculture, holdet har designet den såkaldte tartronyl-CoA (TaCo) pathway, der er meget kortere end naturlig fotorespiration og kun kræver 5 i stedet for 11 enzymer. Den måske største fordel ved TaCo-vejen er, at den fikserer CO 2 i stedet for at frigive det, som det sker ved naturlig fotorespiration. Som resultat, TaCo-vejen er mere energieffektiv end nogen anden foreslået fotorespiratorisk bypass til dato.
Opbygningen af TaCo-vejen var en videnskabelig rejse, der har ført forskerne fra beregningsmodeller gennem enzymatisk ingeniørarbejde, mikrofluidisk high-through screening, kryo-EM-teknologi til succesfuld in vitro implementering af en ny-til-natur metabolisk forbindelse, der åbner nye muligheder for CO 2 fiksering og produktion af værdiskabende forbindelser. "Den største udfordring ved at realisere TaCo-vejen var at finde alle de nødvendige enzymer, " Marieke Scheffen, Postdoktor i Tobias Erbs gruppe og hovedforfatter af undersøgelsen, husker. "Det betød, at vi skulle lede efter enzymer, der udfører lignende reaktioner og derefter 'lære' dem at udføre den ønskede reaktion."
Mere effektive enzymer
For TaCo-vejen, oprindeligt blev der fundet en håndfuld enzymer, der var i stand til at katalysere de nødvendige reaktioner. Imidlertid, de viste lav katalytisk effektivitet, hvilket betyder, at de var ret langsomme sammenlignet med naturligt forekommende enzymer. Forskerne havde til formål at øge især ydeevnen af nøgleenzymet i TaCo-vejen, glycolyl-CoA carboxylase (GCC), katalysatoren, der gør fotorespiration kulstofpositiv.
Som et grundlag for at skabe en syntetisk glycolyl-CoA-carboxylase (GCC) udviklede forskerne en molekylær model af enzymet. Forskellige varianter af enzymet blev skabt baseret på en naturligt forekommende propionyl-CoA carboxylase, som normalt er involveret i fedtsyremetabolismen, som et stillads ved at udveksle aminosyrerester. Denne rationelle designstrategi førte til en 50-fold forbedring af enzymets katalytiske effektivitet med glycolyl-CoA.
For at skubbe enzymets ydeevne endnu længere, forskerne slog sig sammen med gruppen af Jean-Christophe Baret fra det franske nationale center for videnskabelig forskning (CNRS, CRPP) Bordeaux, Frankrig, med hvem de udviklede en ultrahigh-throughput mikrofluidisk skærm og screenede tusindvis af syntetiske varianter. Inden for to runder af efterfølgende mikropladescreeninger, der blev opdaget en enzymvariant, der viste en endog næsten 900 gange øget katalytisk effektivitet med glycolyl-CoA. "Med denne katalytiske effektivitet, GCC er i rækken af naturligt forekommende biotinafhængige carboxylaser. Det betyder, at vi var i stand til at konstruere et enzym fra næsten ingen aktivitet mod glycolyl-CoA til meget høj aktivitet, som kan sammenlignes med naturligt udviklede enzymer, " forklarer Marieke Scheffen.
Elektronmikroskopi med høj opløsning
Løsning af den molekylære struktur af denne nyudviklede katalysator blev opnået i endnu et samarbejde, med Jan og Sandra Schuller fra Max Planck Institute of Biochemistry, Martinsried (nu SYMIKRO i Marburg). Forskerne anvendte banebrydende kryogen elektronmikroskopi (cryo-EM) ved en atomopløsning på 1,96 Å, dermed skubbe grænserne for cryo-EM.
Endelig, det syntetiske GCC-enzym viste sig at fungere i in vitro-eksperimenter i kombination med de to andre enzymer i TaCo-vejen, danner således en anvendelig kulstoffikseringsvej. "TaCo-vejen er ikke kun et lovende alternativ til fotorespiration", siger gruppeleder Tobias Erb. "Vi kunne også vise, at det kan forbindes med anden syntetisk CO 2 fikseringscyklusser, som CETCH-cyklussen. Nu vil vi være i stand til effektivt at forbinde syntetisk CO 2 fiksering direkte til centralt stofskifte."
Dette åbner op for en række videnskabelige muligheder, for eksempel til genanvendelse af polyethylenterephthalat (PET). TaCo-vejen kunne bruges til at omdanne ethylenglycol (en monomer af PET) direkte til glycerat, gør det anvendeligt til produktion af biomasse eller værditilvækst forbindelser. Det næste skridt vil være at fremme in vivo implementeringen, for at udnytte det fulde potentiale af den nyudviklede vej.
 Varme artikler
Varme artikler
-
 Sikring af broccolispirer bevarer deres kræftbekæmpende forbindelserKredit:CC0 Public Domain Rå broccolispirer, en rig kilde til potentielle kræftbekæmpende forbindelser, er blevet en populær helsekost i de seneste år. Men konventionel varmebehandling, der bruges
Sikring af broccolispirer bevarer deres kræftbekæmpende forbindelserKredit:CC0 Public Domain Rå broccolispirer, en rig kilde til potentielle kræftbekæmpende forbindelser, er blevet en populær helsekost i de seneste år. Men konventionel varmebehandling, der bruges -
 Forskere isolerer kræftstamceller ved hjælp af en ny metodeForskere ved University of Texas i Dallas har udtænkt en ny teknik til at isolere kræftstamceller, som menes at danne roden til mange svære at behandle metastaserede kræftformer - et væsentligt skridt
Forskere isolerer kræftstamceller ved hjælp af en ny metodeForskere ved University of Texas i Dallas har udtænkt en ny teknik til at isolere kræftstamceller, som menes at danne roden til mange svære at behandle metastaserede kræftformer - et væsentligt skridt -
 Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li
Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li -
 Kunstige celler er små bakteriebekæmpereBiomedicinske ingeniører ved UC Davis har skabt, der efterligner nogle af de levende cellers egenskaber. De kunstige celler vokser og deler sig ikke, men kunne opdage, reagere på og ødelægge bakterier
Kunstige celler er små bakteriebekæmpereBiomedicinske ingeniører ved UC Davis har skabt, der efterligner nogle af de levende cellers egenskaber. De kunstige celler vokser og deler sig ikke, men kunne opdage, reagere på og ødelægge bakterier
- Bleriot XI
- Solar teleskop GREGOR afslører magnetiske detaljer om solen
- Australien skal omfavne transformation for en bæredygtig fremtid
- Hjælper til Iowa -guvernør udmåler Apple -aftale, får job i virksomheden
- Privatlivsvagthunde advarer Facebook om Vægtens valuta
- EU vil tvinge internetvirksomheder til at fjerne terrorindhold


