Forskning bryder ny vej i forståelsen af, hvordan en molekylær motor genererer kraft
Kredit:CC0 Public Domain
Et team af biofysikere fra University of Massachusetts Amherst og Penn State College of Medicine satte sig for at tackle det langvarige spørgsmål om naturen af kraftgenerering af myosin, den molekylære motor, der er ansvarlig for muskelsammentrækning og mange andre cellulære processer. Nøglespørgsmålet, de behandlede - et af de mest kontroversielle emner på området - var:hvordan omdanner myosin kemisk energi, i form af ATP, til mekanisk arbejde?
Svaret afslørede nye detaljer om, hvordan myosin, motoren af muskler og relaterede motoriske proteiner, transducerer energi.
Til sidst, deres hidtil usete forskning, omhyggeligt gentaget med forskellige kontroller og dobbelttjekket, støttede deres hypotese om, at de mekaniske hændelser i en molekylær motor går forud for – i stedet for at følge – de biokemiske hændelser, direkte udfordrende den langvarige opfattelse, at biokemiske hændelser gate den kraftgenererende hændelse. Arbejdet, offentliggjort i Journal of Biological Chemistry , blev valgt som en Editor's Pick for "at give et enestående bidrag til feltet."
Gennemførelse af komplementære eksperimenter for at undersøge myosin på det mindste niveau, forskerne brugte en kombination af teknologier - enkeltmolekyle laserfangning ved UMass Amherst og FRET (fluorescensresonansenergioverførsel) ved Penn State og University of Minnesota. Holdet blev ledet af muskelbiofysiker Edward "Ned" Debold, lektor ved UMass Amherst School of Public Health and Health Sciences; biokemiker Christopher Yengo, professor ved Penn State College of Medicine; og muskelbiofysiker David Thomas, professor ved College of Biological Sciences ved University of Minnesota.
"Dette var første gang, disse to banebrydende teknikker er blevet kombineret for at studere en molekylær motor og besvare et ældgammelt spørgsmål, " siger Debold. "Vi har i 50 år kendt det brede omfang af, hvordan ting som muskel- og molekylære motorer fungerer, men vi kendte ikke detaljerne om, hvordan det sker på det mindste minutniveau, nanoskala-bevægelserne. Det er som om, vi kigger under motorhjelmen på en bil og undersøger, hvordan motoren fungerer. Hvordan tager den brændstoffet og omdanner det til arbejde, når du trykker på gaspedalen?"
Ved at bruge sin enkeltmolekyle laserfældeanalyse i sit laboratorium, Debold og hans team, inklusive kandidatstuderende Brent Scott og Chris Marang, var i stand til direkte at observere størrelsen og hastigheden af myosins mekaniske bevægelser på nanoskala, da det interagerer med et enkelt actin-filament, dets molekylære partner i kraftgenerering. De observerede, at det kraftgenererende trin, eller powerstroke, skete ekstremt hurtigt, næsten lige så snart det bandt sig til aktinfilamentet.
I parallelle eksperimenter med FRET-assays, Yengos team bekræftede denne hurtige hastighed af kraftslaget og viste med yderligere undersøgelser, at de vigtigste biokemiske trin skete efterfølgende og meget langsommere. Yderligere analyse afslørede for første gang, hvordan disse begivenheder kan koordineres af de intramolekylære bevægelser dybt inde i myosinmolekylet.
"Chris Yengo indsamlede sine data adskilt fra mine, og vi kombinerede og integrerede resultaterne, " siger Debold. "Jeg kunne se ting, som han ikke kunne, og han kunne se ting, som jeg ikke kunne, og i kombination var vi i stand til at afsløre ny indsigt i, hvordan en molekylær motor transducerer energi. Det var tydeligt, at mekanikken skete først efterfulgt af de biokemiske begivenheder."
At fremhæve vigtigheden af at undersøge energitransduktion på nanoskalaniveau har meget brede implikationer, Debold forklarer. "Det handler ikke kun om, hvordan muskler fungerer, " siger han. "Det er også et vindue til, hvor mange motoriske enzymer i vores celler, der transducerer energi, fra dem, der driver muskelsammentrækning til dem, der får en celle til at dele sig."
Detaljeret viden om denne proces kan hjælpe forskere en dag med at udvikle behandlinger for sådanne tilstande som hjertesvigt, kræft og meget mere. "Hvis du forstår, hvordan den molekylære motor fungerer, du kan bruge disse oplysninger til at forbedre funktionen, når den er kompromitteret, som i tilfælde af hjertesvigt, " siger Debold. "Eller hvis du ville forhindre en tumorcelle i at dele sig, du kan bruge disse oplysninger til at forhindre kraftgenerering. At vide præcis, hvordan kraftgenerering opstår, kunne være meget nyttigt for nogen, der forsøger at udvikle et lægemiddel til at hæmme en molekylær motor under celledeling, og i sidste ende kræft."
Sidste artikelBiobaserede erstatninger til fossilt brændstofplast
Næste artikelHvorfor fremtidige boliger kunne være lavet af levende svamp
 Varme artikler
Varme artikler
-
 Forskere simulerer processen med klæbende slidComputersimuleringen viser klæbende slid på en selv-affin overflade. Kredit:LSMS / EPFL Overfladeslid beskriver processen med materialetab, når to overflader kommer i kontakt med hinanden. Det har
Forskere simulerer processen med klæbende slidComputersimuleringen viser klæbende slid på en selv-affin overflade. Kredit:LSMS / EPFL Overfladeslid beskriver processen med materialetab, når to overflader kommer i kontakt med hinanden. Det har -
 Hurtigere opdagelse af lægemidler for at ramme uhæmmelige målKredit:CC0 Public Domain Medicin fremstillet af snoede proteinfragmenter kan give et nyt greb om svære at behandle sygdomme som kræft, men de er svære at designe. Men en ny teknik, udviklet ved Un
Hurtigere opdagelse af lægemidler for at ramme uhæmmelige målKredit:CC0 Public Domain Medicin fremstillet af snoede proteinfragmenter kan give et nyt greb om svære at behandle sygdomme som kræft, men de er svære at designe. Men en ny teknik, udviklet ved Un -
 Sådan benævnes AcidsEn syre er en forbindelse, der donerer brintioner, når de opløses i vand. Når det gør dette, frigiver det også de ioner, hvortil hydrogenerne var bundet, inden forbindelsen blev sat i opløsning. En hy
Sådan benævnes AcidsEn syre er en forbindelse, der donerer brintioner, når de opløses i vand. Når det gør dette, frigiver det også de ioner, hvortil hydrogenerne var bundet, inden forbindelsen blev sat i opløsning. En hy -
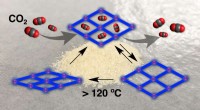 Nye kuldioxid-adsorberende krystaller til biomedicinske materialer, der er afhængige af formhukomme…Forskere dokumenterede, hvordan et porøst materiale kan ændre sig og bevare sin form, selv efter at have absorberet og frigivet kuldioxid. Her, krystallens porer forbliver åbne efter at have frigivet
Nye kuldioxid-adsorberende krystaller til biomedicinske materialer, der er afhængige af formhukomme…Forskere dokumenterede, hvordan et porøst materiale kan ændre sig og bevare sin form, selv efter at have absorberet og frigivet kuldioxid. Her, krystallens porer forbliver åbne efter at have frigivet
- Konstruerede nanobodies blokerer SARS-CoV-2 fra at inficere menneskelige celler
- Fra dating deltagere til sørgende enker, Facebook satser stærkt på underholdning, men vil folk se…
- OSIRIS-REx TAGs overflade af asteroide Bennu
- Hvorfor virksomheder undervurderer behovet for at tilpasse sig ekstreme klimabegivenheder
- Program, der studerer Lake Champlain, kvalificerer sig til op til $ 1 mio
- Billede:NGC 6818 i stjernebilledet Skytten


