Undersøgelse bruger neutroner til at skinne lys på lukning af kræftceller

St. Jude-forsker Eric Gibbs klargør prøver til neutroneksperimenter for at studere forskellige sammensætninger af en proteintumorsuppressor for bedre at forstå dens rolle i at afbøde kræftaktivitet i stressede celler. Kredit:ORNL/Genevieve Martin
Ofte kaldet livets byggesten, celler er komplekse og meget dynamiske. Den genetiske information, der er kodet inde, gør dem i stand til at opbygge biomolekylære komponenter som proteiner, DNA, og RNA, som samles til større, mere komplekse enheder - fra utallige organeller til i sidste ende hele celler - som igen danner væv, der så giver ophav til hele organismer. Kontrol over organisationsniveauerne er afgørende for livet, men ukontrolleret cellevækst forårsager mange dødelige sygdomme, herunder kræft.
For at undersøge, hvad der sker inde i celler, når de er i risiko for at blive kræftsygdomme, forskere, der arbejder i Richard Kriwackis laboratorium på St. Jude Children's Research Hospital, har brugt neutroner ved Department of Energy's (DOE's) Oak Ridge National Laboratory (ORNL). Holdet søger efter bedre at forstå den ændrede tilstand af nukleolus - en membranløs organel inde i cellen - når cellen er kompromitteret. Ny indsigt i celleadfærd på atomare og molekylær skala vil muliggøre bedre påvisning og behandling af kræft i dens mange former.
"I over 100 år har Det har været kendt, at kræftceller har større nukleoler end normale celler. Nukleoler er som væskefabrikker, eller samlebånd til produktion af ribosomer - komplekse enzymer, der forbinder aminosyrer sammen for at danne proteiner. Niveauet af ribosomproduktion er relateret til, hvor hurtigt cellen kan vokse, " sagde Eric Gibbs, en postdoktor, der arbejder i Kriwackis gruppe. "Forebyggelse af ukontrolleret ribosombiogenese er afgørende for at forhindre udbredelsen, eller spredningen, kræftceller i hele kroppen. "
I begyndelsen af 2020, før COVID-19-pandemien begyndte, Gibbs udførte neutronspredningsforsøg ved ORNL's Spallation Neutron Source (SNS) for at studere interaktionerne mellem to nukleolære proteiner - nukleofosmin og et naturligt forekommende tumorsuppressorprotein kaldet den alternative læseramme, eller ARF. ARF-tumorundertrykkeren kommer til udtryk, når celler fornemmer de tidlige ændringer på vejen til at blive kræft - en proces, der kaldes onkogen stress.
Ifølge Gibbs, nukleophosmin hjælper med samlingen af ribosomale komponenter i nukleolen, der omfatter flere protein- og RNA-molekyler. Nucleophosmin fungerer også som en eskorte for samlede præ-ribosomale partikler under deres transport fra kernen - den membranbundne organel, der omslutter nucleolus - til cytoplasmaet uden for kernen, hvor alle cellulære proteiner syntetiseres.
"Når celler oplever onkogen stress, ARF-tumorundertrykkeren er overudtrykt, eller opreguleret, og lukker den ribosomale samlebånd ned ved at få de præ-ribosomale partikler til at sidde fast i nucleolus, dermed stoppe proteinproduktionen, " han sagde.
ARF-tumorundertrykkeren er vigtig, Gibbs sagde, fordi det er blandt de tre bedste gener, der er muteret i næsten alle kræftformer.
Tidligere undersøgelser af St. Jude og andre forskere fandt ud af, at når ARF-genet blev slettet, størrelsen af en celles nucleolus steg, ligesom hastigheden af ribosomsamling. De fandt ud af, at cellen ville producere betydeligt mere protein end raske celler normalt gør, hvilket resulterer i unormal vækst og spredning af kræftceller. Forstå mekanismen, eller præcis hvordan ARF virker, kunne være altafgørende for en dybere forståelse af tumorsuppression, som kunne føre til ny indsigt i forbedret terapi for patienter.
En hypotese vedrørende ARF-mekanismen involverer en proces kaldet væske-væskefaseseparation - den samme proces, hvorved olie og vand adskilles, når de blandes sammen. Mens cellens kerne er fyldt med en væskelignende nukleoplasmavæske indkapslet af en membran, kernen inde i kernen har ingen sådan membranbarriere, bestående i stedet hovedsageligt af proteiner og nukleinsyrer holdt sammen via faseadskillelse.

Forsker Michelle Tolbert, en kollega til Gibbs, der arbejder i Kriwacki Lab på St. Jude Children's Research Hospital, forbereder proteinprøver i opløsning til neutronspredningsforsøg på EQ-SANS-instrumentet på ORNL’s Spallation Neutron Source. Kredit:ORNL/Genevieve Martin
Når nukleophosmin og andre proteiner eller RNA isoleres og blandes sammen i opløsning, faseseparerede dråber dannes. Konsistensen af dråberne ligner nukleolens fysiologiske miljø og giver et modelsystem til at studere interaktionerne mellem nukleophosmin og forskellige proteiner eller RNA'er.
I de fleste tilfælde, dråberne er meget flydende og væskelignende, gør dem i stand til at smelte sammen til større dråber. Men når nukleophosmin blandes med ARF, konsistensen er langt mere gelatinøs, mere stiv, hvilket begrænser dråbefusion markant.
"Så, hvorfor det? Er det noget med organisationen af nukleofosminmolekylerne? Forårsager forskellige koncentrationer af ARF, at nukleofosminmolekylerne er mere eller mindre mobile? Er nukleofosminmolekylerne længere fra hinanden eller tættere på hinanden? Det er ting, vi virkelig gerne vil undersøge, "sagde Gibbs." Vi tror, at det er relateret til virkningerne af ARF på faseseparation med nukleofosmin - muligvis når ARF er overudtrykt, nukleolus bliver en mere stiv struktur, fordi nukleofosminmolekylerne er tættere på hinanden."
Neutroner er ideelle sonder til at studere biologisk stof på grund af deres neutrale ladning, deres ikke -ødelæggende virkning på prøver og deres følsomhed over for lette elementer som brint. De kan bruges til at måle størrelsen, form, og organisering af molekyler i en lang række miljøer og forhold, der er utilgængelige med andre teknikker.
Ved at bruge EQ-SANS-instrumentet på ORNL's SNS, Gibbs var i stand til at analysere de molekylære strukturer af mange forskellige prøver med varierende koncentrationer af ARF og nukleophosmin. Eksperimenterne hjalp med at bestemme, hvordan ARF påvirker den strukturelle organisering af nukleofosminmolekyler inden for faseseparerede dråber i reagensglasset og gav ny indsigt i, hvordan ARF stopper ribosombiogenese i nucleolus, da det undertrykker tumorer.
"En af de fede ting ved neutroner er, at vi er i stand til at bruge kontrastvariation, der giver os mulighed for at skifte mellem at se på kun ARF-molekylerne, eller bare nukleofosminmolekylerne, inden for dråber, udover at kunne se på begge dele på samme tid.
"Vi har allerede identificeret nogle interessante funktioner i ARF-tumorundertrykkeren. F.eks. den har visse hydrofobe motiver, som afviser vand, samt positivt ladede, hydrofile motiver, der tiltrækker vand - som begge påvirker, hvordan ARF binder til nukleophosmin og danner dråber gennem faseadskillelse, " sagde Gibbs. "Jo mere vi kan lære om disse interaktioner, jo bedre rustet vil vi være i kampen mod kræft. "
Kriwacki tilføjede, "Disse observationer, for første gang, vise, at ARF, et centralt tumorundertrykkende protein hos mennesker, skal ses gennem linsen af faseadskillelse for at forstå dens hæmmende virkninger på nukleoler i præ-cancerceller."
 Varme artikler
Varme artikler
-
 Hvad er virkningen af kogning og frysning på enzymaktivitet?Enzymer er kritiske for alt liv, fordi de katalyserer kemiske reaktioner, der ellers ville finde sted for langsomt til at understøtte livet. Det er vigtigt, at de hastigheder, med hvilke enzymer er
Hvad er virkningen af kogning og frysning på enzymaktivitet?Enzymer er kritiske for alt liv, fordi de katalyserer kemiske reaktioner, der ellers ville finde sted for langsomt til at understøtte livet. Det er vigtigt, at de hastigheder, med hvilke enzymer er -
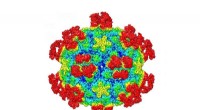 Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc
Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc -
 Atombilleder afslører mange naboer for nogle iltatomerBilleder af ilt (øverste række) og nitrogenatomer (nederste række) i et kulstofnetværk, optaget på mikroskopilaboratoriet ved universitetet i Wien. Blandt de forventede konfigurationer, ilt findes ogs
Atombilleder afslører mange naboer for nogle iltatomerBilleder af ilt (øverste række) og nitrogenatomer (nederste række) i et kulstofnetværk, optaget på mikroskopilaboratoriet ved universitetet i Wien. Blandt de forventede konfigurationer, ilt findes ogs -
 Millioner udsat for potentielt farlige metaller, ny teknologi kan være med til at mindske risikoenLinda Nie, en lektor ved Purdue Universitys School of Health Sciences, været med til at skabe ny teknologi for at forsøge at reducere antallet af mennesker, der er ramt af helbredsproblemer forbundet
Millioner udsat for potentielt farlige metaller, ny teknologi kan være med til at mindske risikoenLinda Nie, en lektor ved Purdue Universitys School of Health Sciences, været med til at skabe ny teknologi for at forsøge at reducere antallet af mennesker, der er ramt af helbredsproblemer forbundet
- Smelte temperaturen af aluminiumfolie
- Vedligeholdelse af tigerforbindelse og minimering af udryddelse i det næste århundrede
- Betydningen af at forvitre
- Sne over Antarktis bufferet havniveaustigning i sidste århundrede
- Kongressmedlemmer sætter spørgsmålstegn ved Google om børns privatliv på YouTube
- Elektroteknik -team udvikler sig ud over 5G trådløs transceiver


